作者简介:卫蓓文,女,1978年生,学士,讲师,主要从事临床免疫学研究。
探讨人类白细胞抗原(HLA)全相合异基因造血干细胞移植(allo-HSCT)后免疫重建的规律。
方法选择42例2009至2013年在瑞金医院血液科骨髓移植病区接受allo-HSCT患者,采用速率散射比浊法检测预处理前和移植后1、3、6、12及24个月的血清免疫球蛋白IgG、IgA、IgM及IgE水平,流式细胞术(FCM)检测预处理前,移植日,移植后14、21 d和1、3、6、12、18及24个月的T淋巴细胞(CD3+、CD3+CD4+、CD3+CD8+)、B细胞(CD19+)及自然杀伤(NK)细胞(CD56+CD16+),总结移植后免疫球蛋白及各淋巴细胞亚群的恢复情况并对影响免疫重建的因素进行探讨。
结果CD3+及CD3+CD8+T细胞移植后14 d开始恢复正常,CD3+CD4+T细胞恢复缓慢,在术后2年内低于或接近正常水平。CD56+CD16+细胞移植后恢复较快,21 d左右开始恢复正常水平。CD19+细胞在移植后6个月左右恢复正常,免疫球蛋白IgM、IgG、IgA恢复正常的时间分别为1、3及6个月。不同性别患者移植后免疫重建无明显差异,供体来自同胞的患者免疫重建速度较非血缘移植快。发生严重感染及Ⅲ~Ⅳ移植物抗宿主病(GVHD)患者CD3+CD8+T细胞水平移植后早期明显高于未发生GVHD及感染者。发生Ⅲ~ⅣGVHD患者移植后早期CD3+细胞明显高于未发生GVHD患者,并且CD3+CD4+T细胞恢复有延迟趋势。
结论allo-HSCT后淋巴细胞亚群的免疫重建顺序依次是:CD56+CD16+,CD3+CD8+,CD19+及CD3+CD4+。HLA全相合有利于免疫重建,移植治疗中抗胸腺球蛋白的应用、移植后GVHD发生等是影响免疫重建的最重要因素。
To investigate the immune reconstitution after human leukocyte antigen (HLA)-matched allogenetic hematopoietic stem cell transplantation (allo-HSCT).
MethodsA total of 42 patients undergoing allo-HSCT from 2009 to 2013 in the Blood and Marrow Transplantation Center, Department of Hematology, Ruijin Hospital were enrolled in this study. The immunoglobulin levels of IgG, IgA, IgM and IgE prior to preconditioning and at 1, 3, 6, 12 and 24 months after transplantation were determined by rate nephelometry. T lymphocytes (CD3+, CD3+CD4+ and CD3+CD8+), B cell (CD19+) and natural killer (NK) cell (CD56+CD16+) levels were determined by flow cytometry(FCM) prior to preconditioning, at the day of transplantation, 14 and 21 d, 1, 3, 6, 12, 18 and 24 months after transplantation. The recovery of immunoglobulin and lymphocyte subsets was analyzed, and the impacts of pre-and post-transplantation variables were evaluated.
ResultsThe levels of CD3+ and CD3+CD8+ returned to be normal at 14 d after transplantation, while the recovery of CD3+CD4+ was slow, and its level remained lower than or closer to be normal in 2 years after transplantation. CD56+CD16+ recovered rapidly and returned to be normal at approximately 21 d after transplantation. CD19+ were back to be normal at 6 months after transplantation, and the recovery times of IgM, IgG and IgA were 1, 3 and 6 months, respectively. No significant differences were found in the immune reconstitution between male and female patients. The immune reconstitution of sibling donor transplantation was faster than that of unrelated donor transplantation. The levels of CD3+CD8+ at early stage of post-transplantation were significantly higher in patients with severe infection and Ⅲ-Ⅳ graft-versus-host disease (GVHD) than those in patients without infection and GVHD. For patients with Ⅲ-Ⅳ GVHD, CD3+ was significantly higher than that for patients without GVHD at early stage of post-transplantation, while the recovery of CD3+CD4+ tended to be slow.
ConclusionsThe lymphocyte subsets recover after allo-HSCT in the following order: CD56+CD16+, CD3+CD8+, CD19+ and CD3+CD4+. HLA matching benefits the immune reconstitution. The application of anti-thymocyte globulin and GVHD occurrence after transplantation are the most important factors influencing the immune reconstitution.
造血干细胞移植(hematopoietic stem cell transplantation,HSCT)目前被广泛用于治疗血液病,影响预后的一个重要因素是患者免疫功能的重建。如果免疫重建延迟,可能会增加感染风险、移植后疾病复发及继发恶性肿瘤[ 1]。在异基因造血干细胞移植(allogeneic hematopoietic stem cell transplantation,allo-HSCT)时为了预防移植物抗宿主病(graft-versus-host disease,GVHD)发生,会对移植物做T细胞体外剔除或应用大量免疫抑制剂体内去除T细胞,均在一定程度上导致免疫重建延迟。目前国内外HSCT后免疫重建研究报道尚少且结论并不一致。本研究检测并分析了allo-HSCT前后2年内患者淋巴细胞亚群的变化及免疫球蛋白水平变化,以期寻找免疫重建规律与相应临床指标间的联系,为移植术前后免疫重建的监测、免疫抑制剂的应用和调整、移植后感染及GVHD预防和治疗等提供重要的参考数据。
入选2009至2013年在上海交通大学医学院附属瑞金医院血液科骨髓移植病区进行的42例具有完整免疫重建随访数据的allo-HSCT患者,其中男27例,女15例,年龄(33±12)岁,最小15岁,最大58岁。纳入患者中急性淋巴细胞白血病(acute lymphoblastic leukemia,ALL)18例、急性髓性白血病(acute myeloid leukemia,AML)15例、慢性粒细胞淋巴细胞白血病(chronic myeloid leukemia,CML)7例、非霍奇金淋巴瘤(non-hodgkin's lymphoma, NHL)1例,骨髓增生异常综合征(myelodysplastic syndromes, MDS)1例。移植供体来源为同胞移植全相合13例,无血缘关系全相合29例。所有研究对象移植后发生感染7例、严重排异(Ⅲ~ⅣGVHD)11例、植入不良6例,复发5例。最短随访期3个月,最长36个月,中位随访期12个月。
1. 预处理方案 以白消安+环磷酰胺为基础的清髓性预处理29例(69%),剂量为:白消安每天3.2 mg/kg持续4 d、环磷酰胺每天60 mg/kg持续2 d;以氟达拉滨+白消安+阿糖胞苷为主预处理13例(31%),剂量为:氟达拉滨25 mg/m2持续5 d、白消安每天3.2 mg/kg持续3 d、阿糖胞苷2 g/m2持续5 d。
2. GVHD的预防 环孢菌素A+吗替麦考酚酯+短程氨甲喋呤,自第-1天开始每天持续静脉应用环孢菌素A 3 mg/kg,调整剂量维持谷浓度在200~300 ng/mL,口腔溃疡愈合及胃肠道反应消失后改为口服;如无GVHD发生,则于干细胞回输后3个月起逐渐减量,移植后5~6个月停用。第+1天始应用吗替麦考酚酯1.0 g/次,每12小时服用1次,移植后1~2个月停药(同胞全相合移植1个月;非血缘2个月)。第+1天予氨甲喋呤15 mg/m2;第+3、+6、+11天各予氨甲喋呤 10 mg/m2静脉注射。非血缘供体移植患者加用抗胸腺球蛋白,第-4天~第-1天给药,总剂量6 mg/kg。
3. 免疫重建的检测 (1)于预处理前,移植后1、3、6、12及24个月分别检测患者外周血血清IgG、IgA、IgE及IgM水平。检测方法为速率散射比浊法,仪器为贝克曼-库尔特公司IMMAGE 800;(2)于预处理前,移植日,移植后14及21 d和1、3、6、12、18及24个月分别检测患者外周血CD3+、CD4+、CD8+、CD16+、CD56+、CD19+细胞。检测方法为六色直接免疫荧光法,仪器为BD公司Canto Ⅱ流式细胞仪。抗体选用BD公司生产的六色单克隆抗体CD45-藻红蛋白-花青素(phycoerythrin and cyanidin, PC5)和CD3-异硫氰酸荧光素(fluorescein isothiocyanate,FITC)/CD16+56-藻红蛋白(phycoerythrin,PE)。无菌采集患者外周静脉血2 mL,乙二胺四乙酸抗凝。标本按如下方式操作:①试管中加入5 μL单克隆抗体CD45/CD4/CD8/CD3/CD56+CD16/CD19;②加入已混匀的30 μL抗凝血;③避光室温孵育15~20 min;④加入200 μL工作浓度的溶血素,振荡器上混匀,室温避光放置10~15 min后加入200 μL磷酸盐缓冲液振荡混匀,上机操作。结果为阳性百分数。
采用SPSS17.0统计软件分析,符合正态分布的计量资料以 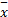
allo-HSCT后患者IgM恢复较快,1个月恢复正常;IgG移植后1个月水平偏低,至3个月左右恢复正常;IgA恢复较慢,移植后6个月内水平持续低下,6个月左右恢复正常。IgE在移植前以及移植后未见明显变化,在移植后6个月呈现逐步升高趋势。见表1。
表1 移植前后外周血免疫球蛋白检测结果[IgG、IgA、IgM: ±s;IgE:中位数(范围)] ±s;IgE:中位数(范围)] |
allo-HSCT后患者14 d内CD3+T细胞明显降低,移植后14 d至1个月开始逐步恢复正常,而术后1个月至1年内水平稍高于正常水平,至移植后2年趋于恢复正常;CD3+CD4+T细胞亚群移植后恢复缓慢,自移植后14 d起恢复,大部分患者在2年内低于或接近正常水平,小部分患者恢复正常。CD3+CD8+T细胞亚群恢复较快,移植后14 d内水平低下,大部分患者自14 d开始恢复正常并在2年内略高于正常水平。CD56+CD16+细胞移植后恢复较快,21 d左右开始恢复或接近正常水平。CD19+细胞在移植后6个月内降低,6个月恢复正常。见表2。
| 表2 移植前后外周血淋巴细胞亚群检测结果[中位数(范围)] |
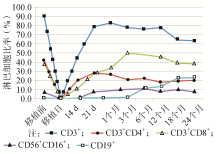
在随访的42例患者中,21例患者外周血干细胞移植后恢复过程中未发生严重感染、重度GVHD、植入不良以及复发。将上述患者移植前后T淋巴细胞亚群变化趋势总结发现,移植日T细胞亚群检测水平均极低,外周血几乎检测不到各种淋巴细胞表面标志物的表达。CD3+、CD3+CD8+T淋巴细胞及CD56+CD16+细胞均在术后1个月恢复正常水平,并在术后2年内水平较稳定。CD3+CD4+T细胞术后1个月接近正常水平,虽与术后发生各种并发症患者比较未发现统计学差异,但其总体水平较高,中位数26.3(4.0~55.2)%,后者21.0(0.7~69.2)%。CD19+细胞在术后半年恢复并在2年内持续升高。见图1。
本研究就免疫重建可能相关因素进行了系列的分析,包括性别、年龄、干细胞来源、感染以及是否发生GVHD。42例患者中男27例,女15例,移植后各阶段检测中血清免疫球蛋白水平及淋巴细胞亚群恢复上无明显差异。年龄分布>45岁者7人,<45岁者35人,统计发现CD3+及CD3+CD4+T淋巴细胞恢复上两者无差异,但>45岁的患者CD3+CD8+细胞恢复趋势上慢于<45岁的患者,术后1个月前者中位数27.0(18.2~38.5)%,后者为38.3(7.8~80.9)%( P=0.011),术后3个月两者无明显差异。
在42例人类白细胞抗原(human leukocyte antigen, HLA)全相合移植中,同胞移植13例,非血缘移植29例,统计发现同胞移植患者术后T淋巴细胞恢复较非血缘移植快,移植后 14 d已开始恢复,CD3+细胞为79.2(0.0~98.1)%,非血缘移植者为46.4(0.0~90.0)%( P=0.004);CD3+CD4+细胞同胞移植者30.3(0.0~80.3)%,非血缘移植者12.7(0.0~64.3)%( P=0.000);移植后1个月CD3+细胞两者无明显差异,而CD3+CD4+细胞依然差异有统计学意义( P=0.000),非血缘移植患者大多数未恢复,仅为12.9(0.7~12.4)%,同胞移植者为29.4(22.5~45.2)%;直至移植后3个月两者CD3+CD4+细胞水平无明显差异。CD3+CD8+细胞非血缘移植者恢复稍慢于同胞移植,至术后半年两者无明显差异。
移植后发生严重感染患者7例,均发生于移植后3个月内。统计发现在移植后1个月发生感染患者CD3+CD8+细胞水平明显高于未发生感染患者,感染患者为55.7(37.7~87.5)%,未发生严重感染患者为26.3(7.8~74.5)%( P=0.028)。
移植后发生Ⅲ~Ⅳ严重GVHD患者其移植后早期14 d CD3+细胞水平明显高于未发生严重GVHD患者,发生GVHD患者CD3+细胞为86.9(0.0~94.8)%,未发生严重GVHD患者为64.5(0.0~96.3)%( P=0.009);重度GVHD患者移植后14 d CD3+CD8+细胞水平明显高于未发生严重GVHD患者,重度GVHD患者为29.3(0.0~66.4)%,未发生严重GVHD患者为11.3(0.0~56.3)%( P=0.003)。CD3+CD4+细胞虽然两者未发现明显差异,但未发生严重GVHD患者术后1个月总体水平高于发生严重GVHD患者,前者为21.5(4.0~69.2)%,后者为17.0(4.0~50.8)%。
HSCT是治疗血液系统恶性疾病、实体瘤、先天性代谢疾病的重要手段之一,移植术后免疫系统重建是移植成功的关键之一[ 2]。免疫重建包括细胞和体液的免疫重建[ 3]:(1)T细胞数量及功能的恢复;(2)B细胞数量及功能的恢复;(3)NK细胞免疫功能的重建;(4)免疫系统有效抗原表达。Schlenke等[ 4]报道移植后NK细胞恢复最快,移植后2~4周开始回升,1个月其数量和功能可以达到甚至略高于正常水平。B细胞基本可在6至12个月内恢复[ 5],也有报道需要1年以上时间[ 2]。T细胞既是细胞免疫的重要参与者,也是体液免疫的调节者,因此T细胞的免疫重建必须受到关注。不同T细胞亚群移植后恢复情况具有异质性,CD3+细胞一般在移植后3~6个月恢复正常水平[ 6],CD3+CD4+T细胞亚群移植后恢复缓慢,移植术后1至2年内仍处于持续低水平,甚至2至5年才恢复[ 7],CD3+CD8+T细胞亚群则移植后重建相对较快,术后3个月可开始恢复正常水平[ 8]。
本研究监测了42例在瑞金医院骨髓移植中心做allo-HSCT的患者移植前后T细胞亚群、NK细胞、B细胞及免疫球蛋白水平的变化,发现CD3+和CD3+CD8+淋巴细胞在移植后1个月左右均已恢复至正常水平,比相关报道得到的数据要早,尤其移植后无显著并发症的患者,并且恢复后在随访期间也未出现明显波动。这一结果仅反映移植后无感染和严重GVHD等并发症患者正常免疫重建的特征,而一旦出现严重感染和GVHD,CD3+CD8+细胞的恢复则出现显著偏移,而感染病例CD3+CD8+细胞则异常增高。相反CD3+CD4+T淋巴细胞移植后恢复总体较慢,与国内外其他报道一致,多数自2周起开始缓慢恢复,但在随访期间多数患者始终处于相对低水平并未恢复至正常范围。这一现象可能是与allo-HSCT患者移植前必须接受大剂量化疗和免疫抑制剂,尤其是非血缘供体接受抗胸腺球蛋白治疗导致胸腺功能受抑有关。移植后T细胞免疫重建途径主要有2条:(1)外周途径。不依赖胸腺功能,移植物中T细胞受到抗原刺激后在外周免疫器官内增殖;(2)胸腺依赖途径。淋巴样细胞迁移至胸腺,在胸腺内发育为初始淋巴细胞,从而形成稳定持久的免疫重建。因此移植后胸腺的再生能力受损,胸腺输出功能下降甚至丧失,体内淋巴细胞极度缺乏,激化了机体自稳机制,体内残余淋巴细胞及来自于供体少数淋巴细胞在外周血中发生稳态性增殖,由于CD8+细胞增殖不显著依赖于胸腺功能而移植后较快恢复,但CD4+细胞依赖于胸腺功能而恢复缓慢[ 9],这也部分解释了移植后患者在较长时期内CD4/CD8比值下降及倒置的原因。
本研究发现CD19+细胞在移植后6个月内得以恢复,但IgG水平先于B细胞恢复,这一原因可能与较多的患者移植后曾经静脉注射免疫球蛋白制剂有关。IgA水平恢复相对缓慢,一般于6个月左右升至正常,与B细胞恢复时间同步。NK细胞恢复则较快,多数患者于移植后1个月恢复,部分患者在1至3个月间水平高于正常,与前述报道相一致。
本研究在对免疫重建的相关影响因素分析中发现,不同性别患者移植后免疫重建无显著差异。既往认为年龄大者由于免疫重建功能较差,且其功能脏器欠佳不适合行HSCT,但本研究发现>45岁的移植患者移植后CD3+及CD3+CD4+T淋巴细胞恢复趋势上与年轻患者无明显差异,虽然移植术后1个月>45岁患者CD3+CD8+T淋巴细胞水平明显低于<45岁患者,但均达到正常范围。因此随着预处理方法及移植技术的改进,HSCT后免疫重建问题对年老患者不是限制性因素。此外研究发现发生Ⅲ~Ⅳ严重GVHD患者,其移植后14 d CD3+细胞明显高于未发生GVHD患者,而患者大多于术后3周至1个月左右发生Ⅲ~ⅣGVHD。在实体器官移植如肾移植术后也有报道发现发生排斥反应时CD3+细胞会增高[ 10],因此CD3+细胞相对增高对移植后发生的排斥反应或GVHD可能均有预示作用。发生严重GVHD患者其免疫重建延迟,特别是CD3+CD4+T淋巴细胞重建影响尤为明显,可能与大剂量激素或其他免疫抑制剂治疗GVHD导致的免疫抑制有关[ 11],本研究虽未发现是否发生GVHD间存在统计学差异,但在移植后1个月和2年内的趋势发现发生GVHD组与未发生GVHD组比较,均呈现降低的趋势,与Jiménez等[ 12]的报道一致。早期发生严重感染和未发生感染的患者比较,发现前者CD3+CD8+细胞明显增高并超过正常水平,与Servais等[ 13]的报道有相似发现。
总之,本研究发现allo-HSCT后淋巴细胞亚群的免疫重建顺序依次是:CD56+CD16+、CD3+CD8+、CD19+及CD3+CD4+。HLA全相合有利于免疫重建,移植治疗中抗胸腺球蛋白的应用、移植后GVHD发生等是影响免疫重建的最重要因素,术后早期过高表达的CD3+CD8+细胞可能可以作为预示GVHD及感染的因子。移植后免疫重建的问题近年来已经成为该领域的研究热点之一,了解allo-HSCT后免疫重建规律有助于提前干预治疗,减少GVHD及感染乃至复发。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|