作者简介:胡梅琮,女,1988年生,硕士,技师,主要从事损伤相关分子模式方面的研究。
探讨胞外三磷酸腺苷(eATP)在刀豆蛋白A(ConA)诱导小鼠急性肝损伤中的表达及意义。
方法将72 只昆明种小鼠随机分为对照组(36只)、ConA组(36只)。ConA组由尾静脉处注射20 mg/kg ConA,对照组注射同体积的无致热原生理盐水。2组分别于注射后2、6、12、18、24、48 h留取血液标本和肝脏标本。采用赖氏法检测血清丙氨酸氨基转移酶(ALT)活性,苏木素-伊红(HE)染色法检查肝组织病理学改变,化学发光技术检测血清eATP水平,免疫印迹法检测肝组织嘌呤受体P2(P2X7)蛋白的表达,酶联免疫吸附试验(ELISA)检测血清白细胞介素1β(IL-1β)水平。
结果成功构建ConA诱导小鼠肝损伤模型。ConA注射2 h后,ConA组血清eATP水平出现增高,并于注射后18 h达峰值(700 nmol/L);同时在小鼠肝组织中检测到P2X7受体的表达。ConA组各时间点血清IL-1β水平均明显高于对照组(
在ConA诱导的小鼠急性肝损伤模型中,损伤肝组织出现明显的eATP释放,并可能通过P2X7受体途径影响炎症细胞因子IL-1β的合成和分泌,从而参与急性肝损伤的进程。
To observe the expression and significance of extracellular adenosine triphosphate (eATP) in concanavalin A (ConA)-induced murine acute liver injury model.
MethodsA total of 72 mice were randomly classified into control group (saline, 36 cases) and ConA group (20 mg/kg ConA, 36 cases). The blood specimens and liver tissues were collected at 2, 6, 12, 18, 24 and 48 h after injection. The activities of serum alanine aminotransferase (ALT) were measured by Reitman Frankel assay. Hematoxylin-eosin (HE) dyeing was carried out to assess the pathological change of liver tissue. The levels of eATP in serum were detected by chemiluminescence. Western-blot was employed to detect the expression of purinoceptor P2(P2X7). The contents of serum interleukin 1 beta (IL-1β) were assayed by enzyme-linked immunosorbent assay (ELISA).
ResultsThe ConA-induced murine acute liver injury model was constructed successfully. The level of eATP increased at 2 h after ConA injection, and reached peak at 18 h (700 nmol / L). Meanwhile, there expressed P2X7 in liver tissues. Compared with control group, the IL-1β levels in serum of ConA group increased significantly (
In ConA-induced murine acute liver injury model, eATP releases from the injury liver tissues, and might influence the synthesis and secretion of inflammatory cytokine IL-1β through the P2X7 pathway, eventually aggravating the process of acute liver injury.
细胞内三磷酸腺苷(adenosine triphosphate,ATP)是重要的能量贮存和供给物质,细胞内ATP缺失将导致细胞死亡;除此之外,因参与机体神经、血管及免疫等系统中细胞间对话,胞外ATP水平会出现瞬间升高[ 1]。在正常组织中,细胞内释放出的ATP由于胞外ATP(extracellular ATP,eATP)/二磷酸腺苷(adenosine diphosphate,ADP)酶的作用,其浓度总是维持极低水平。当细胞在受损、应激、缺氧等情况下会释放出大量ATP,并作为内源性危险信号通过嘌呤受体P2(P2X7)受体途径,引起炎症复合体活化,从而触发成熟白细胞介素1β(interleukin 1beta,IL-1β)的合成和释放,启动并进一步放大炎症反应、维持细胞介导的免疫反应[ 2]。刀豆蛋白A(concanavalin A,ConA)是一种植物凝集素,小鼠尾静脉注射后可引发急性肝损伤,表现为Kupffer细胞活化及肝组织的大片坏死。在这种明显的组织损伤及应激微环境中,是否出现了ATP的释放?释放的eATP是否参与ConA诱导急性肝损伤进程?目前尚不清楚。我们以ConA诱导小鼠急性肝损伤为模型,动态检测eATP在肝损伤组织中的表达变化,同时观察其受体P2X7在受损肝组织中的表达,并探寻其与炎症细胞因子IL-1β之间的关系,为进一步阐明急性肝损伤发生的免疫学机制提供实验依据。
昆明种小鼠72 只,7~9 周龄,体重2226 g,雌雄各36只,普通级,购自安徽医科大学实验动物中心。
ConA购自美国Sigma公司;血清丙氨酸氨基转移酶(ALT)试剂盒购自长春汇力生物技术有限公司;小鼠IL-1β酶联免疫吸附试验(enzyme-linked immunosorbent assay,ELISA)试剂盒购自美国R&D公司;ATP检测试剂盒购自北京原平皓生物技术有限公司;兔抗小鼠P2X7抗体购自英国Abcam公司;HRP标记的山羊抗兔IgG二抗购自北京中杉金桥公司。
1. ConA诱导小鼠急性肝损伤模型制备及标本采集 72 只昆明种小鼠适应性喂养1周后随机分为对照组和ConA组,每组36只。ConA组由尾静脉处注射ConA,剂量为20 mg/kg;对照组注射同体积的无致热原生理盐水(normal saline,NS)。于注射后2、6、12、18、24、48 h分别采用乙醚吸入法麻醉小鼠。从小鼠肝门附近的下腔静脉取血,待血凝固后700× g离心30 min分离血清,进行ALT活性和eATP水平的检测;颈椎脱臼法处死小鼠后,摘取肝脏,取约100 mg肝组织立即冻入液氮中,用于提取肝组织总蛋白,检测P2X7蛋白的表达。剩余肝组织置10%中性甲醛中固定,用于苏木素-伊红(hematoxylin-eosin,HE)染色进行组织病理学检查。
2. 血清ALT活力检测 采用赖氏比色法检测血清ALT活力。具体操作严格按试剂盒说明书进行,每份样本进行双份检测,取平均值。
3. HE染色肝组织病理学检查 取各时间点固定过的肝组织块,常规脱水、包埋制成蜡块,4 μm连续切片,经HE染色后,中性树胶封片,光学显微镜下观察肝脏组织病变情况并拍照。
4. 血清eATP水平测定 采用化学发光技术检测血清eATP水平,仪器为GloMax®-Multi Jr化学发光仪。根据制定的标准曲线计算样品中的ATP浓度,严格按试剂盒说明书操作。每份样本进行双份检测,取平均值。
5. 肝组织中P2X7蛋白水平 采用免疫印迹法检测肝组织中P2X7蛋白水平。用组织裂解液对肝组织块进行匀浆后,于4 ℃ 12 700× g离心30 min,吸取上清肝组织,采用二喹啉甲酸(BCA)法进行总蛋白定量测定。将20 μg蛋白经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gelelectrophoresis, SDS-PAGE),转移至硝酸纤维素膜上。用5%封闭液封闭3 h,兔抗鼠P2X7抗体4 ℃孵育过夜,TBST洗涤3次,辣根过氧化物酶标记的山羊抗兔IgG二抗室温孵育1 h,TBST洗涤3次;涂ECL试剂于全自动数码凝胶图像分析系统中进行曝光,保存图像。
6. 血清IL-1β水平测定 采用桥联法(ABC-ELISA)检测血清IL-1β水平。严格按试剂盒操作说明进行,每份样本进行双份检测,取平均值。
采用SPSS 13.0软件进行统计分析。数据呈正态分布,用 
1. ConA组和对照组小鼠生存状态观察 对照组小鼠48 h内无一例死亡,小鼠敏捷好动,食欲正常;而ConA组注射ConA后12 h内有3只小鼠死亡,24 h内又死亡2只,累计死亡率为13.9%,存活的小鼠精神萎靡、反应迟缓、体温较低、鼠毛竖立蓬乱、饮食及饮水均减少。
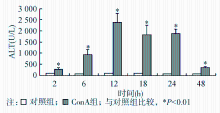
2. 各时间点血清ALT活性的变化 对照组各时间点的血清ALT为(44.12±9.20)U/L,均在正常范围内波动,未见明显改变。ConA组注射ConA后2 h即可见ALT活性明显增高,624 h一直维持高水平,至48 h依然明显高于对照组( P<0.01),见图1。
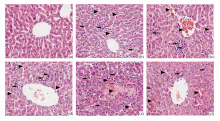
3. 肝组织病理学检查 肉眼观察可见ConA注射后6 h起肝脏明显肿大,呈深暗红色,可见点状或小片状出血,质地更脆,稍碰易碎;24 h后肝脏仍肿胀,较前略显苍白。光镜下对照组肝小叶结构清晰,肝细胞以中央静脉为中心呈放射状排列,形成肝细胞索,细胞结构正常;ConA组小鼠肝组织呈现典型炎症病理改变:早期(2、6 h)肝细胞胞质疏松,呈现明显肿胀变性,小叶内可见炎性细胞散在或灶状浸润,血管内充血明显;至12、18 h肝细胞大片坏死,坏死区红细胞堆积、炎细胞浸润明显;24、48 h仍可见肝细胞肿胀,排列紊乱,大量炎细胞浸润,红细胞堆积。见图2。
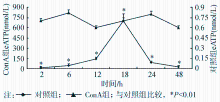
对照组小鼠释放至肝静脉血清中的eATP水平非常低,约为0.7 nmol/L。ConA组在注射ConA 2 h后血清eATP水平有所增加(约为15 nmol/L),以后逐渐升高,至18 h出现峰值,达703 nmol/L,随后缓慢回落,在48 h时依然高于对照组( P<0.01)。见表1、图3。
表1 ConA诱导肝损伤模型中eATP的水平 ( 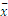 |
采用免疫印迹法检测小鼠肝组织中P2X7蛋白。结果发现在小鼠肝组织内表达P2X7受体,但相对于对照组,ConA组注射后各时间点P2X7的表达水平未发生明显改变。见图4。
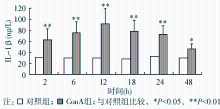
对照组各时间点血清IL-1β水平差异无统计学意义( P>0.05)。ConA组在注射ConA后血清IL-1β水平迅速增高,注射后248 h内一直维持在较高水平,与对照组比较差异有统计学意义( P<0.05)。见图5。
急性肝损伤是一个炎症级联反应过程,发病机制复杂,涉及多种因素的参与及相互作用,其中固有免疫反应的作用越来越受到人们的重视。固有免疫细胞通过表达模式识别受体(pattern recognition receptor,PRR),可以识别组织细胞在感染、损伤和应激情况下产生的内源性危险信号,即损伤相关分子模式(damage-associated molecular pattern,DAMP),启动天然免疫及炎症反应。这是人类炎症性疾病,尤其是无菌性炎症的发病机制之一[ 3]。
ATP是近来较为关注的一种DAMP。P2X7受体是ATP门控的阳离子通道蛋白,在单核巨噬细胞、小胶质细胞中均有表达。细胞在受损、应激、缺氧等情况下会释放出大量ATP,并作为内源性危险信号与嘌呤P2X7受体相结合,引起ATP门控阳离子通道开放,导致钾离子(K+)外流。胞内低K+可激活NLRP3炎症小体,同时招募pennexin-1介导引起更大的膜通透孔,胞外其他病原体相关分子模式(pathogen-associated molecular pattern,PAMP)或DAMP可进入胞内直接激活NLRP3炎症小体[ 4, 5, 6]。这是近来发现的有关NLRP3炎症小体的激活机制之一,也是eATP作为DAMP分子参与炎症性疾病[ 7]的主要机制。此外,eATP还能诱导吞噬细胞白细胞介素6(interleukin 6,IL-6)的转录,在单核细胞转化为巨噬细胞的过程中发挥重要作用;还能引起星形胶质细胞中核因子-κB(nuclear factor-kappa B,NF-κB)和转录激活蛋白1(activator protein 1,AP-1)的高表达,参与中枢神经系统的炎症性病变。
ConA尾静脉注射入小鼠体内后,随血液循环迅速到达肝脏,主要激活CD4+ T 淋巴细胞与Kupffer细胞,产生多种炎性细胞因子[如肿瘤坏死因子-α(tumor necrosis factor-alpha,TNF-α)、γ-干扰素、白细胞介素2等],引起免疫性肝损伤[ 8]。ConA诱导的肝损伤主要表现为Kupffer细胞活化及肝组织的大片坏死。在这种明显的组织损伤及应激微环境中,我们推测应该会出现DAMP的大量释放,且DAMP在ConA诱导的小鼠急性肝损伤机制中应该扮演着重要角色。
本研究发现经小鼠尾静脉注射ConA 2 h后即可见血清ALT活性增高,并在48 h内一直维持高水平;通过对肝组织HE染色的观察,结果也呈现出典型的炎症病理损伤,说明ConA诱导小鼠急性肝损伤的模型构建成功。
进一步检测小鼠血清中炎症细胞因子水平。结果发现血清IL-1β水平于注射ConA后2 h即明显增高,且一直维持高于对照组的水平。IL-1β是一类重要的促炎症因子,能诱导自身及IL-6、白细胞介素8(interleukin 8,IL-8)、TNF-α等多种促炎细胞因子和黏附分子的表达。由于IL-1β缺少信号肽,不能通过经典的内质网-高尔基体通路分泌。炎性细胞产生IL-1β主要依赖一种称为炎症复合体的多蛋白复合物[ 9]。NLRP3是目前研究较多的与内源性危险信号识别有关的炎症复合体之一。体外实验表明NLRP3依赖的IL-1β产生机制含两种独立的信号转导途径。第一信号:依赖NF-κB的pro-IL-1β的转录上调;第二信号:由刺激因素特异性引起NLRP3活化,进而激活化caspase-1,活化的caspase-1水解pro-IL-1β形成具有生物活性的IL-1β。而激活NLRP3的一条重要途径是ATP-P2X7信号途径[ 10]。因此,本研究对释放至肝周围循环中的eATP水平进行检测。结果显示对照组血清eATP水平极低,而ConA组注射ConA后2 h即可见eATP水平的增高,并一直维持至48 h,与IL-1β的表达增高的趋势较一致;同时还检测到肝组织中有P2X7受体表达。提示在ConA诱导的肝损伤中,释放至细胞外的ATP的局部水平增高,达到激活P2X7受体的阈值,通过激活NLRP3炎症复合体,引起IL-1β的分泌。
体内外实验证明,释放至细胞外的ATP与人类炎症性疾病息息相关[ 11, 12, 13],且新的eATP/P2X7受体轴抑制剂逐渐被发现和应用,并取得良好的治疗效果[ 14, 15]。而本研究发现eATP在ConA刺激后的小鼠肝组织中表达明显增加,阐述了eATP诱导炎症因子IL-1β产生并加重急性肝损伤的机制。临床上各种原因引起的急性肝损伤都会产生细胞损伤和应激微环境,从而激发胞内ATP的释放。后者作为早期危险信号通过引发炎症因子的瀑式反应加重损伤,形成恶性循环,促进疾病的发展。本研究表明在肝损伤的早期即出现明显的ATP释放,提示临床可将血清ATP作为新的肝损伤的辅助诊断指标,同时为制定以抑制ATP释放或封闭其相应作用抗体为靶点的治疗急性肝损伤的新策略提供了理论依据和实验思路。但在ConA诱导的急性肝损伤微环境中还存在很多类型的DAMP(本课题前期工作就证实了HMGB1作为一类DAMP参与了ConA诱导的急性肝损伤进程[ 16])。这些DAMPs相互作用,形成非常复杂的内源性危险信号网络。因此eATP表达的增加是否是肝损伤中IL-1β分泌的直接启动因素及eATP与其他DAMPs间的联系尚有待进一步深入研究。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|