作者简介:唐 婧,女,1988年生,学士,主要从事丙型肝炎的免疫学新进展研究。
采用受试者工作特征(ROC)曲线确定和分析2种不同酶免分析系统酶联免疫吸附试验(ELISA)检测丙型肝炎抗体(抗HCV)的阳性判断值(Cut-off)。
方法收集202份血清,用重组免疫印迹法(RIBA)确认抗HCV,同时采用国产addcare ELISA 1100全自动酶免分析系统(简称addcare ELISA 1100)和进口TECAN+FAME组合的酶免分析系统(简称TECAN+FAME酶免系统)检测抗HCV,对吸光度(
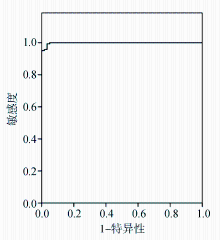
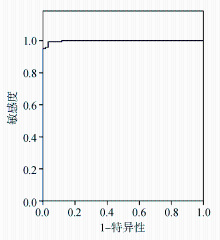
以RIBA结果为金标准,ROC曲线分析结果显示,addcare ELISA 1100检测抗HCV的最佳Cut-off值为0.448,敏感性为99.3%,特异性为96.7%,约登指数为0.960,ROC曲线下面积为0.998,TECAN+FAME酶免系统检测抗HCV的最佳Cut-off值为0.406,敏感性为99.3%,特异性为96.7%,约登指数为0.960,ROC曲线下面积为0.998。
结论采用ROC曲线分析得到两种不同酶免分析系统ELISA检测抗HCV的Cut-off值分别为0.448和0.406,检测抗HCV的“灰区”分别设定为0.140~0.448和0.140~0.406,均可优化检测性能。
To confirm and analyze the cut-off value in anti-hepatitis C virus (HCV) antibody determined by 2 different kinds of enzyme-linked immunosorbent assay (ELISA) analysis systems with receiver operating characteristic (ROC) curve.
MethodsA total of 202 sera confirmed by recombinant immunoblot assay (RIBA) were determined by domestic addcare ELISA 1100 automatic analysis system and imported combined TECAN with FAME ELISA analysis system for anti-HCV antibody. ROC curve was drawn with absorbance (
According to the results of ROC curve, RIBA as the golden standard, the optimal cut-off values were 0.448 in addcare ELISA 1100 automatic analysis system and 0.406 in TECAN+FAME combined ELISA analysis system. Their sensitivities, specificities, Youden indices and areas under ROC curve were 99.3%, 99.3%; 96.7%, 96.7%; 0.960, 0.960 and 0.998, 0.998.
ConclusionsThe cut-off values are 0.448 and 0.406 in the 2 analysis systems with by ROC curve, and the ambiguous regions are 0.140-0.448 and 0.140-0.406.The 2 ELISA analysis systems can optimize the performance of detection.
丙型肝炎病毒(hepatitis C virus,HCV)感染引起的丙型病毒性肝炎呈全球分布,大约有1.7亿人为HCV感染者,占世界人口的3%,且发展中国家高于发达国家[ 1]。丙型肝炎病毒抗体(抗HCV)是目前应用最广泛的用于流行病学调查、临床丙型肝炎患者筛查和诊断的检测项目,为丙型肝炎的早发现、早治疗提供了可靠的依据[ 2]。酶联免疫吸附试验(enzyme-linked immunosorbent assay,ELISA )是抗HCV检测最常用的方法。在免疫定性测定中,确定合适的阳性判断值(Cut-off值)对减少假阳性和假阴性,确保试验的敏感性和特异性具有重要意义[ 3]。研究表明受试者工作特征(receiver operating characteristic,ROC)曲线是设定Cut-off值的最佳方法[ 4]。我们采用ROC曲线确定实验室两种不同酶免分析系统检测抗HCV的最佳Cut-off值,以提高ELISA检测抗HCV的敏感性和特异性。
使用盲法收集2013年3月至2013年5月新疆医科大学第一附属医院医学检验中心血清标本202份,分离血清,置-80 ℃保存待测。标本来源对象年龄1~82岁,男93例,女109例,其中132份来自肝病科门诊和住院患者、70份来自普通门诊患者和体检者。
addcare ELISA 1100全自动酶免分析系统(简称ddcare ELISA 1100,烟台生物科技有限公司);TECAN加样系统(瑞士帝肯公司);FAME后处理系统(瑞士哈美顿公司)。抗HCV确证试剂盒[重组免疫印迹法(recombinant immunoblot assay,RIBA)]由北京万泰生物药业股份有限公司提供(批号为RC20130101);抗HCV诊断试剂盒由(ELISA)北京万泰生物药业股份有限公司提供(批号为C20130406)。所有试剂均在有效期内使用,按说明书操作。
1. 标本检测 对-80 ℃保存待测的202份血清标本分别用上述指定厂家的抗HCV诊断试剂(ELISA)和抗HCV确证试剂(RIBA)进行抗HCV测定和抗HCV确认,记录吸光度( A)值,其中ELISA分别用addcare ELISA 1100和TECAN+FAME组合酶免分析系统(简称TECAN+FAME酶免系统)进行检测。检测前两种系统均进行了校准和性能验证。
2. RIBA确认结果判定 条带强度的判读和结果的解释见表1和表2。
| 表1 RIBA抗HCV反应条带强度的判读标准 |
| 表2 RIBA抗HCV反应结果的判读标准 |
3. 质量控制 ELISA检测每一批分别设定2个阴性对照、2个阳性对照和1个质控,其中阴性对照孔 A值≤0 .08,阳性对照孔 A值≥0.50,否则实验无效,质控孔S/CO值在2.39~4.96的范围内。RIBA检测每一批分别设定1个阴性对照和1个阳性对照,其中阴性对照出现对照线-1和对照线-2,阳性对照出现Core、NS3、NS4-1、NS4-2、NS5、对照线-1和对照线-2,且每条试验结果中对照线-1和对照线-2均必须出现,如果对照线-1和对照线-2均不出现或仅出现1条,则此条的检测结果无效。试验均有良好的质量控制。
4. Cut-off值的验证 EP12-A文件Cut-off值的验证方法:(1)准备具有临界值浓度和浓度在临界值±20%的标本,标本的量要充足,以保证同一份样本能重复测定20次;(2)重复测定每个标本20次,计算出每个标本的阴性和阳性百分比;(3)估计的临界值是否准确,如果准确,同一份样本重复测定的结果应该有50%阳性和50%阴性结果;(4)临界值±20%的浓度范围是否位于该实验方法的“95%区间”,当临界值+20%浓度的标本检测阳性率≥95%,且临界值-20%浓度的标本检测结果阴性率≥95%,则该浓度范围≥该方法95%区间;此时,标本浓度在临界值±20%浓度范围之外就能得到稳定的检测结果。
采用SPSS 17.0软件进行统计分析。用抗HCV A值做ROC曲线,计算曲线下面积,并探讨其最佳临界值即约登指数最大时的Cut-off值,且约登指数为敏感性与特异性之和减去1,从而确定抗HCV诊断价值最大时的Cut-off值。用配对四格表卡方检验探讨ROC曲线确定的两种不同酶免分析系统ELISA检测抗HCV最佳Cut-off值下的检测结果的差异。 P<0.05为差异有统计学意义。
RIBA检测结果为阳性142份,阴性60份。其中142份RIBA阳性标本5个抗原区条带强度分布情况见表3。142份RIBA阳性标本中,Core蛋白、NS3蛋白、NS4-1蛋白、NS4-2蛋白和NS5蛋白阳性的分别有142份、141份、80份、16份和68份,其中强度为2+的分别有125份(88%)、121份(85%)、61份(43%)、9份(6%)和56份(39%),强度为1+的分别有17份(12%)、20份(14%)、19份(13%)、7份(5%)和12份(8%)。
| 表3 142份RIBA阳性标本5个抗原区条带强度分布情况 |
以RIBA检测结果为参照,绘制两种酶免分析系统不同阳性判断值的ROC曲线。addcare ELISA 1100检测抗HCV的最佳Cut-off值为0.448,敏感性为99.3%,特异性为96.7%,约登指数为0.960,ROC曲线下面积为0.998,见图1。TECAN+FAME酶免系统检测抗HCV的最佳Cut-off值为0.406,敏感性为99.3%,特异性为96.7%,约登指数为0.960,ROC曲线下面积为0.998,见图2。两种系统不同临界值时的敏感性和特异性见表4和表5。对比两种系统采用ROC曲线确定的最佳Cut-off值下的抗HCV检测结果,差异无统计学意义( P=1.000)。见表6。
| 表4 addcare ELISA 1100不同临界值下的敏感性和特异性 |
| 表5 TECAN+FAME酶免系统不同临界值下的敏感性和特异性 |
| 表6 两种系统检测抗HCV的最佳Cut-off值下的检测结果(例) |
addcare ELISA 1100检测抗HCV的最佳Cut-off值为0.448。一个 A值约为0 .448的标本重复测定20次获得50 %阳性结果和50 %阴性结果。一个 A值约为0.538(临界值+20%)的标本重复测定20次获得的阳性率为95%。一个 A值约为0.358(临界值-20%)的标本重复测定20次获得的阴性率为100%。
TECAN+FAME酶免系统检测抗HCV的最佳Cut-off值为0.406。一个 A值约为0 .406的标本重复测定20次获得50 %阳性结果和50 %阴性结果。一个 A值约为0.487(临界值+20%)的标本重复测定20次获得的阳性率为95%。一个 A值约为0.325(临界值-20%)的标本重复测定20次获得的阴性率为100%。
ELISA是目前临床检验中应用较为广泛的一种检测方法,其判断测定结果的依据主要依靠所谓的“阳性判断值”,即Cut-off值。虽然各厂家生产的ELISA试剂盒均提供Cut-off值的计算方法,但不同批试剂盒使用相同Cut-off值。多年使用同一Cut-off值的现象普遍存在,这显然存在不合理性。由于试剂盒生产工艺的不均一性,各批试剂盒的反应效果不尽相同,所得的Cut-off值应当不同。此外,环境温度、加样体积误差、洗板效果等方面均是影响ELISA检测性能的因素。为此,各实验室需自行设定并计算适合本实验室的Cut-off值[ 5]。
本研究中的两种系统(addcare ELISA 1100和TECAN+FAME酶免系统)虽然使用同一种抗HCV诊断试剂盒,但是addcare ELISA 1100是加样、后处理一体机,有2个工作舱(前、后舱自动转板,避免污染)和3台独立洗板机(前后舱均可使用,每台洗板机均为96针洗板头,洗板强度大、效果好),开放操作(易受环境温度干扰);TECAN+FAME酶免系统是TECAN加样系统和FAME后处理系统组合的酶免分析系统,人为转板,易污染,2台洗板机(每台洗板机均为24针洗板头,洗板效果较差),后处理机内部操作(受环境温度干扰小)。针对以上不同点,本实验室有必要分别确定两种系统ELISA各自的检测抗HCV的Cut-off值。
Cut-off值的设定方法一般有标准差比率、测定标本对阴性比值、以阴性对照均值±2 s或3 s、百分位数法、双质控、ROC曲线等[ 4]。不同的方法设定的Cut-off值有一定的差异,但都要综合考虑假阳性率和假阴性率。在各种Cut-off值的计算方法中,ROC曲线法已得到了实验室的认可[ 6]。该方法考虑了每一个可能的Cut-off值,因而能够更客观地评价诊断试验的诊断价值和确定最佳临界值。
本研究通过ROC曲线确定addcare ELISA 1100检测抗HCV的最佳Cut-off值为0.448,敏感性为99.3%,特异性为96.7%,约登指数为0.960,ROC曲线下面积为0.998;TECAN+FAME酶免系统检测抗HCV的最佳Cut-off值为0.406,敏感性为99.3%,特异性为96.7%,约登指数为0.960,ROC曲线下面积为0.998。
伍建宁等[ 7]研究通过对5 709份无偿献血者标本的抗HCV ELISA检测的 A值的统计和RIBA检测,确认Cut-off值以0.112为宜,与本研究所确定的Cut-off值(0.448和0.406)相差较大。其原因可能有:(1)Cut-off值的设定方法不同,伍建宁等[ 7]的Cut-off值的设定方法为百分位数法单侧99%,本研究Cut-off值的设定方法为ROC曲线法;(2)仪器与试剂不同,伍建宁等[ 7]使用Genesis RSP-200型全自动标本处理系统加样,德国BEPⅢ全自动酶标仪进行后处理及检测,本研究分别使用addcare ELISA 1100和TECAN+FAME酶免系统检测,伍建宁等[ 7]研究抗HCV ELISA测定试剂盒购自厦门新创生物工程公司,抗HCV RIBA 3.0SIA确认试剂盒购自美国Chiron公司,本研究抗HCV ELISA测定试剂盒和抗HCV RIBA 确认试剂盒均购自同一家公司;(3)标本来源不同,伍建宁等[ 7]研究标本来自5 709份无偿献血者,本研究标本来自202份临床检测者。采供血系统血液筛检抗HCV,Cut-off值的设定应略低于临床抗HCV检测,这对于减少HCV的经输血传播具有重要意义[ 7]。
抗HCV诊断试剂盒说明书上提供的Cut-off值的计算公式为临界值=阴性对照孔A均值+0.12(不足0.02按0.02计算)。因此通常情况下所计算出的Cut-off值为0.140,与本研究所确定的Cut-off值(0.448和0.406)相差较大。若按照说明书上提供的Cut-off值判断阴性和阳性标本,虽然敏感性较高,但是特异性较低,即易出现假阳性。再者,由于ELISA方法学上的缺陷,抗HCV检测出现假阳性的原因有:(1)高球蛋白血症[ 4];(2)类风湿因子(RF)的干扰,如血清或血浆标本中存在RF,则其可与固相上的IgG和酶标记的IgG结合,从而出现假阳性反应;(3)标本中超氧化物歧化酶的干扰;(4)用于固相包被的HCV基因工程抗原不纯[ 8];(5)试剂保存、运输等环节的影响[ 9]。因此会增加临床抗HCV检测的误诊率。若按照本研究确定的Cut-off值判断阴性和阳性标本,虽然敏感性降低,但是特异性升高,即易出现假阴性。抗HCV检测出现假阴性的原因有:(1)HCV感染后到抗体的出现有一个较长的窗口期(平均为6~12周)[ 10];(2)HCV感染的其它阶段。因此会提高临床抗HCV检测的漏诊率。ELISA技术本身在Cut-off值的设置上存在局限性,也就是说在Cut-off值周围一定区域内,测定结果难以明确判断是阴性还是阳性,即所谓的灰区,而这个灰区到底有多大,在国内使用的ELISA试剂盒中均无说明。这种一刀切的判断方式所得到的结果存在假阴性的可能[ 7]。
综上所述,虽然从理论上而言,ROC曲线是设定Cut-off值的最佳方法,但是由于ELISA测定通常有较大的变异,其每次测定的Cut-off值都会有所差异,因此需要控制Cut-off值的批间变异,但在实际应用中有一定的局限性[ 3]。因此,综合抗HCV诊断试剂盒说明书上提供的Cut-off值(0.140)和经ROC曲线确定的两种系统的Cut-off值(0.448和0.406)的诊断性能,将本实验室addcare ELISA 1100和TECAN+FAME酶免系统检测抗HCV的“灰区”分别设定为0.140~0.448和0.140~0.406。对于ELISA检测抗HCV中的“灰区”结果,最好采用较为敏感和特异的方法进行复检,以免误诊和漏诊。有条件的实验室可以用确认试验对结果进行确认。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|