探讨碳青霉烯类耐药的铜绿假单胞菌同源性及其主要耐药机制。
方法收集临床标本946份,分离出碳青霉烯类耐药的铜绿假单胞菌,采用琼脂稀释法进行体外药物敏感性试验;采用肠杆菌基因间重复一致序列为引物的聚合酶链反应(ERIC-PCR)进行耐药菌株同源性分析;筛选其金属β-内酰胺酶并测定主动外排系统表型来分析碳青霉烯类耐药的铜绿假单胞菌的耐药性。
结果共检测出75株碳青霉烯类耐药的铜绿假单胞菌; ERIC-PCR同源性分析显示75株菌株共分为8个型别,其中A型占34.7%(26株)、B型占22.7%(17株);75株碳青霉烯类耐药的铜绿假单胞菌中有13株为产酶株,产酶率为17.3%;外排泵抑制剂MC207110可以使34株美罗培南耐药株的最低抑菌浓度(MIC)较单药时下降4倍或以上,占63.0%。
结论本院分离的耐碳青霉烯类铜绿假单胞菌主要有两种类型,产生碳青霉烯水解酶和外排泵机制是碳青霉烯类耐药铜绿假单胞菌耐药的重要机制。
To investigate the homology and main drug resistance mechanism of carbapenem-resistant
A total of 946 samples were collected, and carbapenem-resistant
A total of 75 isolates of carbapenem-resistant
There are mainly 2 kinds of cloning existing in
铜绿假单胞菌( Pseudomonas aeruginosa, PA)是一类氧化酶阳性的革兰阴性非发酵杆菌,为临床常见的条件致病菌,是医院感染的主要病原菌之一[ 1, 2, 3]。近年来随着抗菌药物的滥用,常引起医院感染的爆发和流行,且近年来发病呈上升趋势。进行碳青霉烯类耐药铜绿假单胞菌的临床分型及其药物敏感性情况分析,对于预防和控制多重耐药菌的传播、指导临床感染控制工作特别是传染源和传播途径的追踪具有重要意义。
收集2012年1月至2013年8月龙华新区人民医院及龙华新区观澜人民医院和光明新区人民医院各科感染患者的各类标本(包括痰、血、分泌物、尿、咽拭子、脓液、胸腹水、胆汁、脑脊液、引流液等) 。
按《全国临床检验操作规程》(第3版)对各种临床标本进行接种培养,用BD BBTM CrystalTM AutoReader自动微生物鉴定系统作菌种鉴定,少数不能上机鉴定的菌株采用微量生化管法(广东环凯微生物科技有限公司)进行鉴定。应用琼脂稀释法检测铜绿假单胞菌对12种抗菌药物(药物敏感性纸片购自广州乐通泰生物科技公司)的敏感性,根据美国临床实验室标准化协会(Clinical and Laboratory Standards Institute,CLSI)标准,筛选出碳青霉烯类耐药株,定期用铜绿假单胞菌(ATCC 27853)、大肠埃希氏菌(ATCC 25922)和金黄色葡萄球菌(ATCC 25923)质控菌株做药物敏感性质量控制。最低抑菌浓度(minimal inhibitory concentration,MIC)的测定按CLSI标准进行[ 4]。采用二倍琼脂稀释法测定抗菌药物对铜绿假单胞菌的MIC。
1.煮沸法制备DNA模板
从平板上挑取单个菌落于2 mL LB肉汤培养基中,35 ℃培养至对数生长期,取培养物1 mL,26 000× g离心15 min,弃上清液,沉淀物加入100 μL标本裂解液,充分混匀后100 ℃煮沸15 min,26 000× g离心5 min,取上清液作为模板-20 ℃保存备用。
2.PCR反应体系
总体积50 μL,含ERIC引物2 μL、dNTP 4 μL、Taq DNA聚合酶0.25 μL、模板DNA 2 μL、10×PCR缓冲液5 μL、ddH2O 36.75 μL,稍离心混匀。95 ℃预变性5 min,(95 ℃变性45 s,42 ℃退火30 s,72 ℃延伸60 s)×40循环,72 ℃延伸10 min。
3.电泳
取5 μL产物进行2%琼脂糖电泳(含0.5%溴化乙啶),观察结果并照相。
4.结果判读
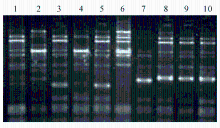
根据美国疾病预防控制中心(Centers for Disease Control and Prevention,CDC)Tenover等[ 5]推荐的方法进行结果判读:图谱完全相同的为同一型;彼此之间相差1个条带的为同一型的不同亚型;相差2~3个条带的为亲缘关系密切;相差4~6个条带的为可能相关;相差7个以上条带的为无亲缘关系。比较不同菌株间ERIC-PCR图谱的相似性。
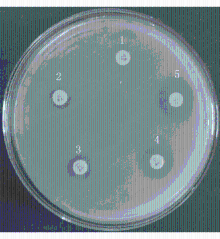
按照文献[3]报道的方法,采用亚胺培南-乙二胺四乙酸(elhylene diamine tetraacetic acid, EDTA)纸片增敏法筛选产金属酶铜假单胞菌。亚胺培南-EDTA纸片增敏协同试验:将孵育在LB肉汤培养基中的试验菌株接种至生理盐水,校正浓度至(0.5±0.05)麦氏标准,15 min内接种至水解酪蛋白琼脂(mueller-hinton, MH)平板。MH平板在室温下干燥3~5 min后,用无菌镊子将5张亚胺培南药物敏感性纸片贴在平板上,各纸片中心间距>24 mm,纸片距平板边缘>15 mm。其中4张滴加5 μL EDTA-Na2(浓度分别为100、200、400和500 mmol/L),置35 ℃温箱过夜后观察结果。若滴加400 mmol/L EDTA的亚胺培南药物敏感性纸片较亚胺培南原药物敏感性纸片的抑菌圈直径≥5 mm,则判断为阳性。以标准株铜绿假单胞菌(ATCC 27853)作为阴性对照。
采用琼脂稀释法测定美罗培南单药MIC值,同时测定加入外排泵抑制剂MC207110(终浓度为20 μg/mL)的美罗培南的MIC值。美罗培南的浓度范围为0.125~256 μg/mL。外排泵表型检测结果的判断:如添加MC207110时美罗培南的MIC值较不添加MC207110的MIC值降低4倍或4倍以上者可认为该菌具有外排泵机制。添加外排泵抑制剂MC207110测定美罗培南的MIC值。(1)制备菌液:从平板上挑取铜绿假单胞菌单个菌落于2 mL LB肉汤培养基中,35 ℃培养5 h左右,用肉汤稀释至吸光度( A625 nm)值=0.1 [相当于细菌数(1~2)×108 CFU/mL],再稀释10倍获得107 CFU/mL的接种浓度;(2)配制MC207110溶液:将所需量的MC207110溶解于无菌水中,过滤除菌;(3)制备加入MC207110的美罗培南2倍稀释系列培养基:MH琼脂温度为55~60 ℃时加入经过滤除菌后的MC207110,混匀,使其终浓度为20 μg/mL;美罗培南取12个稀释度,最高浓度为256 μg/mL,最低浓度为0.125 μg/mL;在平板中分别加入稀释好的美罗培南药液1 mL,加入含MC207110的水解酪蛋白琼脂15 mL,混匀;(4)培养和结果观察:在上述制备的琼脂平板上接种预先稀释好的菌液,37 ℃培养16~18 h,观察并记录结果。
从各类临床标本中共分离病原菌946株,其中铜绿假单胞菌171株,感染率为18.1%,仅次于大肠埃希菌。对亚胺培南和/或美罗培南耐药的铜绿假单胞菌有75株,其对碳青霉烯类抗菌药物的耐药率为43.9%。
75株碳青霉烯类耐药铜绿假单胞菌对亚胺培南和美罗培南的最低抑菌浓度均为MIC50=16 mg/L,结果见表1:
| 表1 75株碳青霉烯类耐药铜绿假单胞菌对亚胺培南和美罗培南的MIC |
ERIC-PCR分型显示75株碳青霉烯类耐药铜绿假单胞菌有A、B、C、D、E、F、G、H共8个型别。部分分型结果见图1。A型:3、5、8、9、10、12、13、15、24、27、29、32、35、37、38、39、41、43、44、46、52、52、57、58、64、73号,共26株;B型:1、6、14、18、21、25、26、33、45、48、53、61、65、66、68、71、75号,共17株;C型:2、4、16、22、36、47、50、56、62、74号,共10株;D型:11、17、19、28、42、54、60、67、72号,共9株;E型:20、31、34、59、63、70号,共6株;F型:23、30、49、69号,共4株;G型:40、51号,共2株;H型:7号,1株。
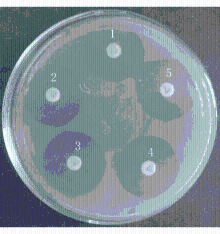
亚胺培南-EDTA纸片增敏协同试验结果显示75株碳青霉烯类耐药铜绿假单胞菌中有13株耐亚胺培南和美罗培南的铜绿假单胞菌随着EDTA-Na2浓度的增加,药物敏感性纸片的抑菌圈逐渐增大,试验结果为阳性,占全部耐药株的17.3%,见图2;质控菌株铜绿假单胞菌(ATCC27853)试验结果为阴性,见图3:
分别测定54株美罗培南耐药铜绿假单胞菌美罗培南单药的MIC值和添加外排泵抑制剂MC207110与美罗培南协同作用后的MIC值。美罗培南对53株亚胺培南和美罗培南均耐药的铜绿假单胞菌的MIC50和MIC90分别为16和32 mg/L,但与20 mg/L外排泵抑制剂MC207110协同作用后,有64.2%(34株)的菌株显示美罗培南的MIC值下降了4~256倍;另有1株亚胺培南敏感而美罗培南耐药菌株的MIC值未见明显改变。若以美罗培南的MIC值下降≥4倍作为判断标准,54株美罗培南耐药铜绿假单胞菌中约有34株(63.0%)的菌株具有外排泵机制。见表2:
| 表2 外排泵抑制剂MC207110对美罗培南的抗菌作用的影响 |
铜绿假单胞菌是临床上重要的条件致病菌之一,该菌耐药性强,耐药谱广,对多种抗菌药物表现为天然或获得性耐药[ 7, 8, 9]。被感染患者往往病情严重,免疫力低下,抗感染能力弱。一旦感染,死亡率很高,临床治疗十分困难。
碳青霉烯类抗菌药物是一类非典型的β-内酰胺抗菌药物,对灭活青霉素和头孢菌素的β-内酰胺酶(包括超广谱β-内酰胺酶等)稳定,可快速渗透革兰阴性杆菌的外膜孔蛋白OprD2通道,与青霉素结合蛋白紧密结合而产生极强的广谱抗菌活性。
1991年,Versalovic等[ 10]发明的针对ERIC进行PCR扩增的ERIC-PCR技术被广泛应用于细菌分类和菌种鉴别上[ 11]。以ERIC片段为靶基因设计引物进行PCR扩增,其保守、独特的位置使得PCR能产生多种独特的扩增产物,从而根据扩增产物的电泳条带来区分细菌的型别。以该重复序列为引物进行的PCR能扩增出多态性的DNA图谱,操作简便,不需要复杂的仪器设备,一般实验室均可建立,便于进行流行病学调查。根据文献报道,铜绿假单胞菌带有与ERIC相似的片段,可选择ERIC-PCR对铜绿假单胞菌进行分型[ 12, 13]。本研究采用ERIC-PCR对75株碳青霉烯类耐药铜绿假单胞菌进行同源性分析。分型结果显示一共有A、B、C、D、E、F、G和H 8个型别,其中以A型和B型为主,分别占34.7%(26株)和22.7%(17株)。提示本研究分离的铜绿假单胞菌耐药株主要以这2种克隆为主。
碳青霉烯类耐药的铜绿假单胞菌产生碳青霉烯水解酶是导致其高水平耐药(MIC≥32 mg/L)的主要机制[ 14]。铜绿假单胞菌中已发现的碳青霉烯酶包括金属酶和丝氨酸酶。因此及时准确地鉴定出产酶株并加以控制,有助于遏制细菌耐药性的传播和流行。本研究采用Dongeun等[ 15]创立的亚胺培南-EDTA纸片增敏协同试验进行金属酶的筛选。该方法可有效地测定产金属酶的铜绿假单胞菌,敏感性为100%,根据预试验结果选择400 mmol/L EDTA-Na2的亚胺培南药物敏感性纸片较原药物敏感性纸片的抑菌圈直径≥5 mm作为阳性标准。结果发现,在75株碳青霉烯类耐药铜绿假单胞菌中有13株为产酶株,对亚胺培南和美罗培南均耐药,产酶率为17.3%,高于国内其他地区医院报道的10%左右的检出率。提示产金属酶是铜绿假单胞菌耐碳青霉烯类抗菌药物的机制之一。另外,外排泵抑制剂MC207110是一种由苯丙氨酸、精氨酸与3-氨基喹啉组成的二肽酰胺,能明显抑制铜绿假单胞杆菌的Mex外排泵系统和大肠杆菌的AcrAB外排泵系统,使细菌恢复对抗菌药物的敏感性。本研究采用琼脂稀释法分别测定54株美罗培南耐药铜绿假单胞菌对美罗培南单药和添加MC207110的美罗培南的MIC值。结果显示外排泵抑制剂MC207110可以使34株(63.0%)美罗培南耐药株的MIC值较单药时下降4倍及以上。提示碳青霉烯类耐药铜绿假单胞菌的外排泵机制是其产生耐药性的重要原因之一。
随着碳青霉烯类抗菌药物的广泛应用,铜绿假单胞菌对其产生的耐药性也日趋严重。本研究检测了深圳市龙华新区观澜人民医院碳青霉烯类耐药铜绿假单胞菌菌株型别,从表型研究的角度进行了产金属酶耐药菌的鉴定和外排抑制试验,初步探讨了碳青霉烯类耐药铜绿假单胞菌的耐药机制,有助于研究者进行流行病学分析和加强临床合理应用抗菌药物,延缓铜绿假单胞菌对该类菌药物耐药性的发展。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|