1996年, Watson等[ 1]发现了人乳腺珠蛋白 (human mammaglobin, hMAM) 基因, 并初步证明该基因是乳腺癌 (或乳腺) 细胞特异性表达基因。自hMAM发现以来, 国内外学者利用各种方法, 如逆转录聚合酶链反应 (reverse transcription-polymerase chain reaction, RT-PCR) 、免疫组化等检测乳腺或乳腺癌组织以及外周血中hMAM基因的表达情况, 发现hMAM基因在乳腺癌诊治过程中具有重要作用[ 2, 3, 4, 5]。但这些检测方法均存在一定局限性, 如RT-PCR生成的mRNA容易降解[ 6, 7]。近年来, 研究发现外周血中hMAM基因所编码的蛋白含量则相对比较稳定[ 8, 9, 10, 11],且国内、外关于检测血清hMAM蛋白的研究报道甚少。为此, 我们采用酶联免疫吸附试验 (enzyme linked immunosorbent assay, ELISA) 检测了乳腺癌患者血清hMAM水平, 探讨hMAM与乳腺癌早期诊断以及癌微转移早期发现的相关性。
收集西安医学院第一附属医院2008年6月至2011年12月住院和门诊筛查患者107例, 其中乳腺癌患者68例 (包括浸润性导管癌56例、混合型浸润性导管小叶癌5例、浸润性小叶癌3例、黏液腺癌4例),男1例, 女67例, 年龄36~65岁;良性乳腺疾病患者35例 (乳腺增生20例、纤维腺瘤12例、纤维性乳腺囊性病3例),男3例, 女32例, 年龄35~65岁;其他癌症患者40例 (前列腺癌、胃癌、卵巢癌、直肠癌各10例),男18例, 女22例, 年龄35~70岁。所有患者均有明确的病理诊断和临床分期。68例乳腺癌患者按临床TNM分期分为Ⅰ期 (20例) 、Ⅱ期 (20例) 、Ⅲ期 (20例) 、Ⅳ期 (8例);按是否存在雌激素受体 (estrogen receptor, ER) 表达分为ER(+)(48例) 、ER(-)(20例);按是否绝经分为绝经前 (36例) 、绝经后 (32例);按是否有腋窝淋巴结转移分为有转移 (48例) 、无转移 (20例) 。以同期西安医学院第一附属医院健康体检正常女性40名作为正常对照组, 年龄35~65岁。
hMAM ELISA试剂盒购自美国RD公司;安图斯洗板机和安图斯2010型酶标仪购自匈牙利Anthos公司。
1.标本采集 所有对象均于清晨空腹抽取静脉血3 mL, 室温静置20 min后2 500×g离心5 min获取血清,-70 ℃保存待测。癌症患者和乳腺良性肿块患者于术前1 d抽取血液标本。
2.血清hMAM检测 加40 μL样品稀释液至各酶标包被板的样品孔内, 再加血清10 μL;封板膜封板, 放入37 ℃温育箱温育30 min;揭开封板膜, 弃除液体, 洗板机洗板5次, 拍干后每孔加酶标试剂50 μL, 用封板膜封板后37 ℃温育30 min;揭开封板膜, 弃除液体, 重复洗板5次后, 拍干后每孔加显色剂A、B各50 μL, 37 ℃避光显色15 min, 再加终止液50 μL。以空白为对照, 450 nm波长测量吸光度(A)值。
使用 SPSS16.0 统计软件进行统计分析。采用受试者工作特征 (ROC) 曲线确定血清hMAM诊断乳腺癌的Cut-off值, 计算ROC曲线下面积、敏感性和特异性。组间血清hMAM水平比较采用t检验, 率的比较采用χ2检验。P<0.05为差异有统计学意义。
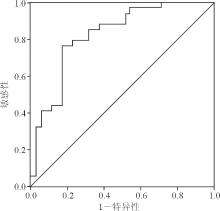
根据68例乳腺癌和75例非乳腺癌 (35例良性乳腺疾病、40名正常对照者) 血清hMAM水平绘制ROC曲线, 其ROC曲线下面积为0.825, 即诊断乳腺癌的可信度为82.5%[95%可信区间(CI):72.6%~92.4%]。乳腺癌患者血清hMAM的Cut-off值为8.43 ng/mL, 此时hMAM筛查乳腺癌的敏感性和特异性分别为76.5%、82.9%,见图1。本研究以血清hMAM>8.43 ng/mL作为阳性结果。
乳腺癌患者血清hMAM水平及阳性率明显高于良性乳腺疾病组、其他癌症组和正常对照组(P<0.05),而良性乳腺疾病组、其他癌症组和正常对照组之间差异均无统计学意义(P>0.05) 。见表1:
| 表1 各组血清hMAM水平及阳性率比较 |
Ⅲ、Ⅳ期乳腺癌患者的血清hMAM阳性率 (55%、75%)明显高于Ⅰ、Ⅱ期患者 (25%、40%,P<0.05),有腋窝淋巴结转移的乳腺癌患者血清hMAM阳性率 (88%)明显高于无转移的患者 (30%,P<0.05),但hMAM水平差异均无统计学意义(P>0.05) 。不管乳腺癌患者血清中是否存在ER、原癌基因C-erb-2表达及是否绝经, 其血清hMAM水平及阳性率均无差异(P>0.05) 。见表2:
| 表2 乳腺癌不同分组的血清hMAM阳性率比较 |
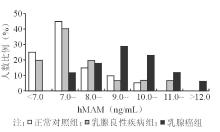
乳腺癌组、乳腺良性疾病组及正常对照组血清hMAM水平在8.0 ng/mL左右及之前有部分重叠, 但从9.0 ng/mL之后乳腺癌组人数明显高于其他2组;而良性乳腺疾病组和正常对照组血清hMAM水平人数大致相同。见图2:
乳腺癌是女性群体中最常见的恶性肿瘤, 也是当今世界女性重要的公共健康问题。在乳腺癌早期 (转移前或转移初期) 能够得到及时诊治, 对于改善预后和降低死亡率至关重要[ 12]。当前, 有一些敏感性较高的方法被用来癌症筛查, 特别是利用患者外周血检测癌细胞和肿瘤标志物, 这些方法涉及到的生物学技术包括流式细胞术、RT-PCR、免疫组化、荧光定量聚合酶链反应 (Q-PCR) 、ELISA等[ 7, 8, 10]。
hMAM基因是第1个应用差异筛选分离到的新的乳腺癌相关基因, 定位于11q13, 编码1 个相对分子质量为10 000 的糖蛋白, 与1个上皮分泌蛋白家族中的 hCC10 蛋白、rUg、rPSC3具有同源性。hMAM基因能在部分乳腺肿瘤中扩增出。Watson等[ 1]认为hMAM基因具有组织特异性, 只在乳腺中表达。这使hMAM基因有可能成为有助于乳腺癌诊断的肿瘤标志物。Berustein等[ 10]和Zehentner等[ 11]研究发现hMAM基因表达具有乳腺特异性, 可以作为一种乳腺癌标志物用于乳腺癌的诊断和微转移的监测。
癌转移是致使乳腺癌患者死亡的首要原因。但目前即使高分辨率的成像技术也不能检测到肿瘤细胞的早期转移[ 13]。流式细胞术、RT-PCR、ELISA等具有较高敏感性的检测方法可以用来筛查外周血中扩散的癌细胞以及癌基因的表达。利用RT-PCR检测血清中hMAM mRNA表达以筛查乳腺癌微转移比较常见, 但该方法也有一定的缺陷:mRNA易降解, 致使血液标本不能长时间保存, 而在短时间内又不能得到大量的乳腺癌患者血液标本用于较大规模的检测、统计及分析。Berustein等[ 10]认为血清中的hMAM蛋白在反复冷冻、溶解的条件下亦可长时间的保存。本研究利用ELISA检测血清中hMAM蛋白水平的变化, 其方法步骤虽复杂、繁琐, 注意事项也颇多, 但研究中涉及的主要环节均严格按照规定的方法制备试剂并进行测定, 力求各个步骤操作标准化, 如加样准确、保温处理、洗涤彻底和比色等。在此基础上, 由于ELISA中酶的高催化性产生的高反应性使测定方法达到很高敏感度的优点得到充分发挥。因此, 对检测乳腺癌患者血清中hMAM蛋白具有较高的可信性。本研究结果显示血清hMAM对乳腺癌的诊断可信度较高, 达82.5%;当Cut-off值为8.43 ng/mL时其敏感性和特异性分别为76.5%、82.9%。乳腺癌患者血清hMAM水平及阳性率明显高于良性乳腺疾病患者、其他癌症患者及正常对照者(P<0.05) 。乳腺癌患者血清hMAM阳性率与其临床分期和是否有腋窝淋巴结转移有关(P<0.05),而与ER、原癌基因C-erb-2表达及是否绝经无关(P>0.05) 。血清hMAM>9.0 ng/mL的乳腺癌组人数明显多于乳腺良性疾病组和正常对照组。以上结果说明hMAM与乳腺癌具有相关性, 能用于乳腺癌的早期诊断。本研究结果显示不管乳腺癌患者临床TNM分期、ER是否表达、是否绝经、是否有腋窝淋巴结转移, 其血清hMAM水平均无差异(P>0.05) 。究其原因可能与hMAM在乳腺癌中出现高表达, 即高特异性有关[ 10, 11]。
综上所述, hMAM有可能成为一种较为理想的诊断早期乳腺癌的肿瘤标志物, 对乳腺癌的早期诊断及微转移的早期发现具有重要的临床意义。随着研究技术的进步和人类对肿瘤的深刻认识, 相信hMAM会很快地被列为临床常用的肿瘤检测指标, 更好地指导临床医生对乳腺癌疾病的早发现、早诊断和早治疗。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|