作者简介:蒋玲丽,女,1980年生,硕士,主管技师,主要从事免疫学和分子生物学的质量控制工作。
探讨实时荧光定量聚合酶链反应(PCR)测定乙型肝炎病毒核酸(HBV DNA)的室内质控方法。
方法统计上海地区PCR实验室HBV DNA常规条件下前20次室内质控数据的不精密度(
分别采用13
PCR检测HBV DNA当实验室前20次室内质控数据
To investigate the internal quality control of hepatitis B virus (HBV) DNA determination by real time fluorescence quantitation polymerase chain reaction (PCR).
MethodsThe coefficients of variation (
When the concentrations of the internal quality control materials were 5×104 and 5×106 IU/mL, there were no error data detected in laboratory A whose
When the
实时荧光定量聚合酶链反应(polymerase chain reaction,PCR)是国内乙型肝炎病毒核酸(HBV DNA)检测应用最广泛的方法。检测结果直接影响临床治疗效果的监测,故其质量控制工作尤其重要。其中室内质量控制(IQC)是确定测定结果是否可靠、可否发出报告的一项重要措施[ 1]。实验室通常采用在常规条件下,每批检测一次质控品,共检测20批次,由这20次数据计算出常规条件下的变异;然后以测出来的均值(x- ±s)和不精密度( CV)绘制质控图,将以后每次测得的质控数据绘制在质控图上,判断是否失控,这也是我们常说的统计学质量控制。上海地区PCR实验室测定HBV DNA的室内质量控制即采用此方法。由于国内PCR测定HBV DNA主要依靠手工进行核酸提取,整个操作步骤繁多,其检测结果差异大,前20次检测数据测得的x-和 CV大小将影响室内质控结果的判断。我们收集2013年上海市实验室PCR检测HBV DNA的室内质控数据,并对其中3家实验室在不同 CV范围内的室内质控数据进行分析,探讨适合实验室的PCR测定HBV DNA的室内质控方法。
1. 收集所有2013年上海市开展HBV DNA项目的PCR实验室的室内质控数据。
2. 统计PCR实验室检测HBV DNA项目的前20次室内质控数据(剔除室内质控数据个数<20个的实验室),计算质控品浓度分别为5×104 IU/mL和5×106 IU/mL时各实验室采用PCR检测HBV DNA的 CV。
1. 对PCR实验室分别按前20次室内质控数据 CV≥10%、5%~<10%和1%~<5%进行分组。通过室内质控软件,筛选出质控数据≥20个(不包括前20个数据)的实验室。
2. 在满足筛选条件的实验室中,分别在不同 CV范围内随机抽取1家实验室。然后收集这3家PCR实验室的2013年所有室内质控数据,分别统计3家实验室前20次室内质控数据的均值(x- ±s)、标准差( s)和 CV。并按 CV≥10%、5%~<10%和1%~<5%标记为A、B和C实验室。
3.采用13 s/22 s的多规则质控方法,通过质控软件判断3家实验室的室内质控数据。
4.采用Levey-Jennings单规则质控方法,通过质控软件判断3家实验室的室内质控数据。
5. 根据室内质控判断结果,结合实验室原始数据的曲线,分析3家实验室的失控数据。
采用EXCEL 2003软件进行统计分析。所有统计均将初始浓度值QDNA进行对数转化为log值(LGQ)后计算。统计结果小数点后保留2位有效数字。
统计各实验室前20次室内质控数据的 CV,计算在质控品浓度分别为5×104 IU/mL和5×106 IU/mL时不同 CV范围下的实验室家数及比例,结果见表1。
| 表1 2013年上海地区各实验室HBV DNA项目室内质控前20次数据统计[实验室数(%)] |
统计室内质控品浓度预期值分别为5×104 IU/mL和5×106 IU/mL时前20次数据的x- ±s、 s、 ±2 s范围和 ±3 s范围。结果见表2。
| 表2 不同 CV范围的实验室HBV DNA项目质控限统计 |
临床PCR检验与其他临床检验一样,产生的误差有两类,包括系统误差和随机误差[ 1]。IQC工作的第一步就是要确定好检测项目的允许总误差(TEa),这是做好IQC工作的前提或基础。将室内质控允许范围定的太窄,假失控率高,势必会浪费资源;定的太宽,假在控率高,会误导临床诊断和治疗[ 2]。目前,国内PCR测定HBV DNA均采用外标法,受模板浓度、PCR反应体系的批间差异影响大;有学者提出必须进行方法学的 CV分析,以此来规范PCR实验室的IQC工作[ 3]。那么多大的 CV在PCR测定HBV DNA项目中是合理的呢?从表1结果显示,前20个室内质控检测数据中各有94.44%的实验室在两个质控品理论浓度为5×104 IU/mL和5×106 IU/mL时的 CV均在10%以下。我们也统计了2013年上海地区2次室间调查和2次飞行检查的数据,剔除有系统偏差的不合格医院的数据后,所有调查品结果的 CV均在10%以下(数据未在文中列出)。相关文献报道[ 4, 5]的PCR测定HBV DNA的 CV也在10%以内。根据统计学理论,定量检验的室内质控,是根据20次独立批次测定的质控结果计算出平均数(x- ±s)和 s,再根据 s设定质控限值进行质控判断的。从表2可以看出,实验室A在质控品浓度为5×104 IU/mL和5×106 IU/mL时,其高、低值质控品±2 s和 ±3 s范围均超过了两个数量级以上,此范围已远超出临床医师的可接受范围。从之后的质控分析看出,无论采用13 s/22 s的多规则质控方法还是Levey-Jennings单规则质控方法,实验室A均未检出一个失控。但进一步分析实验室A的室内质控数据,发现其低值质控最低为3.24×102 IU/mL(已低于系统的检测下限),最高为2.85×105 IU/mL,高值质控最低为2.42×104 IU/mL,最高为3.77×107 IU/mL;分析实验的原始数据发现,其校准曲线提示实验的扩增效率和相关系数均不佳,已是明显的失控;但由于质控范围过宽,未能检出失控。这些检测结果就有可能给临床医师对患者的治疗方案带来误导。按上海地区室内质控要求,PCR测定HBV DNA用于绘制质控图的前20个质控数据的 CV必须小于10%。但随着检测系统的优化以及不同实验室的实际情况,不同实验室可以设定自己的最低 CV要求。
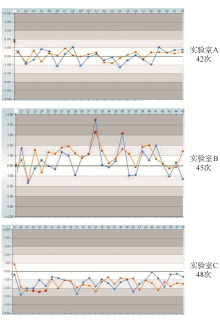
Levey-Jennings质控图是临床检验中最简单和最常用的质控方法,其质控规则仅为单独的12s或13s来判断分析批在控或失控。Westgard等人在Levey-Jennings质控的基础上,建立使用多个规则来进行临床检验质控的方法[ 6]。其中13s对随机误差敏感,22s对系统误差敏感。实验室B在质控品浓度为5×104 IU/mL和5×106 IU/mL时,其前20次质控数据的 CV分别为6.49%和5.00%,通过室内质控软件分别采用13s/22s的多规则质控方法和Levey-Jennings单规则质控方法,从图1和表3可以看出,均在第32和36次检出了失控。结合当日的标准曲线分析,第32次实验的扩增效率(E)为57.06%,第36次实验的E为74.87%,通常PCR实验E的范围在90%~110%,实验室B的两次扩增效率超过了3%以上范围。因此,这两次失控为真失控,并为随机误差引起。分析实验室C的室内质控数据,分别采用13s/22s的多规则质控方法和Levey-Jennings单规则质控方法,采用13s/22s的多规则质控方法共检出3次22s失控,而采用Levey-Jennings单规则质控方法未检出失控。结合实验室C这3次当日的标准曲线分析,E为97.63%~104.89%,分析阈值和 r均在可接受范围内;从质控图观察,实验室质控数据从第22次检测起开始偏低,并且直至第48次检测,整个检测数据全部偏于中心线下方。所以可以确定这3次失控均为系统误差引起的失控。但如果实验室采用的是Levey-Jennings单规则质控方法,这种由系统误差引起的失控将不会被发现。系统误差是由预知的原因引起的,如更换检测方法学、更换仪器、更换试剂和环境改变等。而通过进一步分析,实验室C在第22次检测起更改了试剂品牌,由此确定实验室C的3次失控均是由于试剂更换引起的系统误差。通常在更换检测系统后,实验室应该对实验检测数据进行重新初始化,并重新计算 s值设置质控限,并对后面的检测数据重新进行质控判断。
综上所述,PCR测定HBV DNA室内质控的初始化 CV在10%以上时,会导致无法正确检出失控。当 CV在10%以下时,采用Levey-Jennings单规则质控方法,会导致系统误差漏检。故我们认为PCR测定HBV DNA的室内质控工作必须进行 CV分析,设定实验室最低的 CV要求,并且建议采用多规则的质控方法。但具体规定多少为允许的 CV和采用哪几个多规则质控规则还应根据各实验室的情况,并通过大量的数据去进一步验证后确定。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|