作者简介:张 健,男,1970年生,博士,副主任技师,主要从事免疫学和实验室质量控制工作。
构建增强型绿色荧光蛋白(eGFP)标记的甲胎蛋白(AFP)的融合蛋白,并对其稳定性和测量特性进行分析。
方法从pcDNA3.0质粒中扩增eGFP序列,插入质粒PET28a,构建eGFP表达质粒PET28a-eGFP。根据美国国立生物技术信息中心(NCBI)数据库中的AFP编码序列,应用序列合成方法合成AFP编码序列,并加入连接eGFP的铰链序列,与eGFP序列链接,构建表达质粒PET28a-eGFP-AFP。分别表达和纯化重组蛋白eGFP和eGFP-AFP,分析重组蛋白的荧光特性及稳定性。
结果成功构建和纯化重组蛋白eGFP和eGFP-AFP,荧光光谱分析显示其激发和发射光谱一致。最佳激发波长和发射波长分别为450和509 nm,且荧光可以稳定12个月。表达的eGFP-AFP蛋白可以与常规测定AFP的免疫试剂发生反应。
结论构建表达的重组蛋白eGFP-AFP的荧光特性与eGFP蛋白一致,没有光谱特性变化,并可与常规AFP测定试剂发生反应,为研究eGFP标记的AFP用于校准品和质控品的研究奠定基础。
To construct the fusion protein of alpha fetoprotein(AFP)-enhanced green fluorescent protein(eGFP) recombinant, and to analyze the stability and measurement characteristics.
MethodsThe sequence of eGFP was amplified from pcDNA3.0 plasmid and inserted PET28a plasmid to construct expression plasmid PET28a-eGFP. The coding sequence of AFP was synthetized according to the coding sequence of AFP from the National Center for Biotechnology Information (NCBI) database, added and linked to eGFP sequence by a linker sequence to construct expression plasmid PET28a-eGFP-AFP. Recombinant protein eGFP and eGFP-AFP were purified, and the measurement characteristics and stability were analyzed.
ResultsThe expression plasmid of recombinant protein eGFP and eGFP-AFP were constructed, and the proteins were purified. Recombinant protein eGFP and eGFP-AFP had the same excitation spectrum and emission spectrum, which were 450 and 509 nm optimally, and its fluorescence could be stable over 12 months. eGFP-AFP could be tested for the level of AFP by routine AFP immunoassay.
ConclusionsRecombinant protein eGFP and eGFP-AFP have the same fluorescence characteristics and could react with routine immunoassay which establishes the foundation for the next research using eGFP-AFP as calibration and quality control materials.
绿色荧光蛋白(green fluorescent protein,GFP)由于其良好的荧光特性,不需要任何外源性底物和辅助因子,且具有无毒、稳定、无污染等优良的物理特性,已作为全新的报告分子被广泛的应用于分子生物学研究[ 1, 2]。
作为原发性肝癌、精原细胞肿瘤等恶性肿瘤的诊断及治疗监测的指标,甲胎蛋白(alpha fetoprotein,AFP)是目前应用最为广泛的肿瘤标志物之一[ 3, 4]。但是生物高分子AFP蛋白多样性的抗原表位差别导致抗体特异性出现差异,从而使基于抗原抗体反应原理的常规免疫学测定方法之间的结果出现不一致,影响了不同方法、实验室之间结果的相互比较,也阻碍了AFP测定方法标准化的进展[ 5]。虽然世界卫生组织(World Health Organization,WHO)等国际组织制备了AFP的标准物质。但这种标准物质来源于患者血清,使用放射免疫、免疫电泳等测定AFP的方法进行定值,因受本身定值方法的限制,无法溯源到国际单位[ 6]。为此,我们尝试构建增强型GFP(enhanced-GFP, eGFP)标记的AFP融合蛋白。由于标记物与AFP蛋白是等摩尔的表达水平,在重组融合蛋白荧光光谱不变的条件下,可以将eGFP蛋白的稳定性和优良的光学特性用于AFP的间接定量,为AFP标准品的定值提供一种新的赋值方式。
1. 菌株和质粒 大肠杆菌BL21、质粒pcDNA3.0、质粒PET28a由中科院上海生命科学研究院细胞与生物化学所提供。
2. 试剂和仪器 各种DNA限制酶、T4DNA链接酶购自Takara公司;TaqDNA聚合酶、DNA回收试剂盒购自上海申工公司;蛋白质分子量标准购自Thermo公司;镍亲和层析树脂购自Novagen公司;聚合酶链反应(polymerase chain reaction,PCR)引物、AFP编码序列合成委托上海捷瑞公司完成;BECKMAN-COULTER Access2全自动免疫分析仪及配套试剂、校准品购自Beckman-Coulter公司。ABBOTT Architect i1000全自动免疫分析仪及配套试剂、校准品购自Abbott公司。ROCHE cobas e411全自动免疫分析仪及配套试剂、校准品购自Roche公司。
1. PET28a-eGFP表达质粒的构建 以pcDNA3.0质粒为模板,根据eGFP两端序列设计引物,扩增eGFP的编码序列。扩增产物经1.0%的琼脂糖凝胶电泳验证后,用DNA纯化试剂回收。通过PET28a质粒Nde1及Sal1酶切位点将GFP编码序列插入PET28a质粒,转化大肠埃希菌BL21,经37 ℃培养过夜,阳性克隆用于PCR鉴定及提取质粒用于DNA测序验证。
2. PET28a-eGFP蛋白纯化 取1 μL PET28a-eGFP表达质粒转化宿主菌大肠埃希菌BL21,经37 ℃培养过夜,挑选阳性克隆菌株接种含卡那霉素(50 μg/mL)的LB培养基,37 ℃、220 r/min摇床培养至 A280 nm=0.4时加入异丙基硫代半乳糖苷(isopropyl-β-d-thiogalactoside,IPTG)诱导,25 ℃培养12 h后观察菌落荧光。收获细菌,超声裂解细菌,应用镍亲和层析柱在非变性条件下纯化GFP蛋白,十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)鉴定表达蛋白。
1. PET28a-eGFP-AFP表达质粒的构建 根据美国国立生物技术信息中心(NCBI)数据库检索到的AFP蛋白编码序列(NM-001134.2),应用序列合成方法合成AFP的编码序列,在序列的3'端连接铰链序列,通过定向克隆与表达的eGFP编码序列链接,构建PET28a-eGFP-AFP表达质粒,转化大肠埃希菌BL21,经37 ℃培养过夜,阳性克隆用于PCR鉴定及提取质粒用于DNA测序验证。
2. PET28a-eGFP-AFP蛋白纯化 采用与eGFP蛋白纯化相同的方式表达纯化eGFP-AFP蛋白,应用SDS-PAGE和免疫印迹法鉴定表达蛋白。
应用磷酸盐缓冲液(phosphate buffered saline,PBS)将重组eGFP及eGFP-AFP蛋白稀释成不同浓度的溶液,应用Thermo微量蛋白定量试剂盒为不同浓度蛋白样本定量。对0.5 μg/mL eGFP溶液及0.5 μg/mL eGFP-AFP溶液进行激发光谱和发射光谱扫描。
将重组eGFP-AFP用PBS稀释成不同浓度的样本,分别应用BECKMAN-COULTER Access2全自动免疫分析仪、ABBOTT Architect i1000全自动免疫分析仪、ROCHE cobas e411全自动免疫分析仪检测eGFP-AFP融合蛋白的AFP水平。
采用SPSS 16.0软件和EXCEL 2003软件进行统计分析。所有数据进行正态性检验, P<0.05为差异有统计学意义。
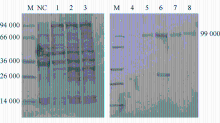
1. PET28a-eGFP表达质粒的构建及鉴定 将eGFP片段插入PET28a表达载体转化DH5a细菌,挑取菌落做菌落PCR检验,见图1。产物经1%琼脂糖电泳显示在792 bp处有清晰条带。同时阳性菌落经质粒抽提和测序验证eGFP序列与GenBank数据一致。
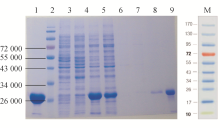
2. eGFP蛋白表达及鉴定 将重组表达质粒在大肠埃希菌BL21中表达,经IPTG诱导,可肉眼观察到菌体的荧光。经超声裂解和镍亲和层析获得的eGFP纯化蛋白经SDS-PAGE证实蛋白预期相对分子质量与预期一致,蛋白在PBS溶液中发出明显荧光。蛋白纯度>95%。电泳结果见图2。
1. PET28a-eGFP-AFP表达质粒的构建及鉴定 根据GenBank检索的人AFP蛋白编码序列(NM-001134.2)委托上海捷瑞公司通过序列合成的方式合成AFP的编码序列(全长1 827 bp)。在合成的编码序列末端加入与eGFP的连接蛋白Linker,以减少AFP与eGFP 两个蛋白的空间位阻。Linker序列以甘氨酸和丝氨酸为主,序列为GGGGSGGG(24 bp)。通过分步连接和酶切将AFP-Linker-eGFP序列插入PET28a质粒,构建PET28a-eGFP-AFP表达质粒。将表达质粒转化宿主菌,挑选阳性克隆抽提质粒进行酶切鉴定和测序鉴定。质粒酶切电泳图显示出现2 643 bp的条带,与插入序列的长度一致。测序结果显示插入序列的编码正确。结果见图3。
2. eGFP-AFP蛋白表达及鉴定 将重组表达质粒在大肠埃希菌BL21中表达,经IPTG诱导,可肉眼观察到菌体的荧光。经超声裂解和镍亲和层析获得的eGFP纯化蛋白经SDS-PAGE证实蛋白相对分子质量与预期一致。蛋白在PBS中发出明显荧光。蛋白纯度>95%。SDS-PAGE结果见图4。
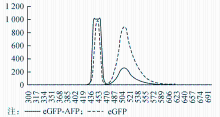
将纯化的eGFP及eGFP-AFP用PBS稀释成0.5 μg/mL,测定荧光激发和发射光谱。eGFP及eGFP-AFP在450 nm存在最佳激发波长,在509 nm存在最大发射峰,且两种蛋白的最大发射波长一致。见图5。
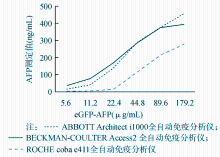
将纯化的eGFP-AFP用PBS稀释成179.2、89.6、44.8、22.4、11.2及5.6 μg/mL共6个不同浓度的样本,分别应用BECKMAN-COULTER Access2全自动免疫分析仪、ABBOTT Architect i1000全自动免疫分析仪及ROCHE cobas e411全自动免疫分析仪检测eGFP-AFP融合蛋白的AFP水平。结果见图6。
AFP是目前应用最为广泛的肿瘤标志物之一。经过过去半个世纪的发展,不同的AFP测定方法被先后应用于临床,包括放射免疫、免疫电泳、酶联免疫以及目前使用的化学发光等方法。但是生物高分子AFP蛋白多样性的抗原表位使常规免疫学测定方法之间的测定结果出现不一致,影响了不同方法、实验室之间结果的相互比较,也阻碍了AFP测定方法标准化的进展。虽然WHO等国际组织制备了AFP的标准物质,但这种标准物质来源于患者血清,使用放射免疫、免疫电泳等测定AFP的方法进行定值。因受本身定值方法的限制,无法溯源到国际单位。这也是免疫测定标准化进展较慢的共性原因[ 7]。
GFP是水母产生的荧光蛋白。其性质稳定、结构简单,能够在原核、真核生物的活体细胞中高效表达。由于其产生的光子稳定,蛋白结构简单。因此,通过荧光强度与蛋白浓度的相关性可以通过光学测定确定GFP蛋白浓度。同时,由于标记物与AFP蛋白是等摩尔的表达水平,在荧光光谱不变的条件下,如果通过GFP蛋白的稳定性和优良的光学特性将GFP准确定量,可间接定量其标记的AFP分子,为AFP标准品的定值提供一种新的方式。
通过分子克隆技术,本研究成功构建了eGFP及eGFP标记的AFP原核表达载体,并通过大肠杆菌表达和纯化了eGFP和eGFP-AFP融合蛋白。通过荧光光谱分析,eGFP和eGFP-AFP融合蛋白的荧光发射和激发光谱没有差异,说明eGFP-AFP的融合表达没有干扰eGFP蛋白的荧光特性。而且二者是等摩尔浓度,因而可以通过测定eGFP-AFP融合蛋白的荧光特性间接定量AFP浓度。
本研究使用BECKMAN-COULTER Access2全自动免疫分析仪、ABBOTT Architect i1000全自动免疫分析仪及ROCHE cobas e411全自动免疫分析仪测定eGFP-AFP融合蛋白,3种常规AFP检测系统均能产生剂量效应关系。提示eGFP-AFP融合蛋白中AFP蛋白的免疫原性完好,能够与多对的抗原抗体组合发生反应。但不同系统的测定结果仍存在差异,也说明不同制造商的产品在实验设计和方案上存在差异。由此提示需要建立较好的校准品溯源体系来协调不同检测系统之间的差异。
本研究以AFP为模板构建eGFP标记的肿瘤标志物融合蛋白,融合蛋白中的荧光蛋白具有较好的稳定性,并且实验证实在部分检测系统上,融合蛋白引入的eGFP蛋白并不影响对AFP的测定。如果通过荧光定量准确获得eGFP的浓度,同时由于eGFP和AFP共表达的等分子模式,将可以获知样本中具有等分子浓度的AFP蛋白。因而可以建立一种通过标记蛋白的荧光特性来间接定量所标记的蛋白的新的赋值方式。eGFP的结构简单,容易分离纯化。因此有可能通过氨基酸定量等参考方法进行赋值,再通过荧光定量方式将赋值浓度通过等分子的形式传递给对相同溶液中的AFP。准确赋值的AFP可以用作校准品进行不同系统之间校准的比较研究,可以用于室间质评计划的正确性验证研究,也可以作为定值质控品用于临床检验的室间质量控制。但是融合蛋白与患者体内的AFP蛋白可能不一致,如何证明其在血清基质当中的可互换性以及其它测量特性有待进一步实验证实。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|