作者简介:牛国平,男,1963年生,本科,主任技师,主要从事免疫学检验和实验室管理工作。
研究江苏徐州地区汉族人细胞色素P450(
采用聚合酶链反应-连接酶检测反应(PCR-LDR)技术检测100名汉族健康受试者及200例临床使用华法林的患者
健康受试者
To investigate the relationship of cytochrome P450(
A total of 100 Han-population healthy subjects and 200 patients with warfarin dosage were enrolled.
There were 91 cases of
华法林是临床上常用的口服抗凝血药。在体内,华法林的代谢具有构象选择性,抗凝作用更强的S-对映体85%以上经由人细胞色素P450(CYP)2C9代谢转化为无活性的6-羟化物和7-羟化物[ 1, 2]。维生素环氧化物还原酶复合体1(VKORC1)是维生素K循环中的关键酶,华法林因抑制该酶而产生抗凝作用。随着药物遗传学的研究进展,目前已经发现 VKORC1和 CYP2 C9基因是目前所知影响华法林用量个体差异最主要的遗传因素。已有学者对这两个基因在华法林剂量个体差异中的作用进行了一系列研究。 CYP2 C9基因具有高度遗传多态性,较常见的基因突变形式是 CYP2 C9 *3[3- 4]。
聚合酶链反应(PCR)-连接酶反应(ligae detection reaction,LDR)检测华法林药物代谢相关基因多态性的方法,具有稳定、快速和准确性高的特点[ 3]。我们拟建立一种适合临床应用的华法林基因检测的新方法。
1. 研究对象 选择徐州市中心医院心内科、心外科门诊和住院患者200例,男、女各100例,男平均年龄46岁,女平均年龄53岁;选择我院体检科100名健康者为对照,男54名,平均年龄48岁,女46名,平均年龄46岁。入选标准:(1)服用华法林调整剂量稳定后至少 7 d;(2)国际标准化比值(INR)控制在 1.5~3.0;(3)治疗期间没有服用影响华法林的药物和食物;(4)所有研究对象相互之间无血缘关系及异族通婚史。所有对象均签署知情同意书。
2. 仪器与试剂 PERKIN ELMER Gene Amp PCR system 9600 PCR仪;ABI PRISM 3100 DNA Sequencer 测序仪;JY600 电泳仪(北京君意东方电泳设备有限公司);FR-200A全自动紫外与可见分析装置和生物电泳图像分析系统(上海复日科技有限公司);Agrose LE(上海捷倍思基因技术有限公司);Qiagen hotstar Taq酶体系(酶5 U/μL,buffer,Q-solution,Mg2+),dNTP(promega,2 mmol/L/each),Axygene PCR microplate 96 well,Axygene PCR tubes(0.2 mL) NEB Taq DNA ligase 酶体系(酶5 U/μL,buffer)
1. 引物探针 PCR引物及LDR探针序列见表1。
| 表1 引物探针序列 |
2. 实验反应条件 10 μL连接反应体系:H2O 7 μL 、PCR产物1 μL 、连接酶缓冲液1 μL、探针1 μL 、连接酶0.05 μL。PCR扩增反应程序:94 ℃ 2 min,94 ℃ 30 s,60 ℃ 2 min,30个循环。
采用Hardy-Weinberg遗传平衡检验,由基因型频率计算等位基因频率。数据以 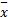
采用3%琼脂糖凝胶电泳观察PCR产物的效果,确定其作为模板在LDR反应中加入的量。结果见图1(实验中主要观察PCR是否成功,对于每个位点是否好无法通过电泳观察)。
患者组和对照组的基因型分布均符合Hardy-Weinberg遗传平衡定律,且两者的 CYP2 C9等位基因频率之间( P=0.876)及 VKORC1(1639G>A)等位基因频率之间差异均无统计学意义( P=0.734),即 CYP2 C9及 VKORC1基因型分布在健康人与血栓性疾病患者中是一致的,见表2。
| 表2 对照组和患者组基因型和基因频率[例(%)] |
200例患者中 VKORC1(1639)基因有168例为纯合子TT,32例为杂合子TC; 200例患者中 CYP2 C9 *3基因有179例为纯合子AA,21例为杂合子AC。见图2~5。
200例患者不同基因型各项临床指标见表3。 VKORC1(1639G>A)基因AA型华法林维持剂量为(2.59±0.83)mg/d,明显低于GA型[(4.51±0.79)mg/d, P<0.05]; CYP2 C9 *1 /*1型华法林维持剂量为(3.01±1.12)mg/d,明显高于 *1/*3型[(2.19±0.32)mg/d, P<0.05]。
表3 CYP2 C9、 VKORC1(1639G>A)不同基因型各项临床指标的比较(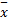 ±s) ±s) |
本研究对徐州地区心血管患者 CYP2 C9基因和 VKORC1(1639G>A)基因多态性进行筛查,发现基因多态性检测在华法林个体剂量使用中起一定的作用。在心血管患者中不同的 CYP2 C9基因型华法林稳定维持剂量间无明显差别,这与文献报道不符,考虑可能有以下因素:(1)样本不够多,不能较好的反映徐州地区汉族人群中 CYP2 C9基因多态性的分布情况及口服药物在不同基因型患者间的分布情况,仅筛选了 CYP2 C9 *3基因型,另一重要基因型 CYP2 C9 *2没有出现在样本中,不能完整的反映 CYP2 C9突变家族对华法林个体药物维持剂量不同的影响;(2)试验设计主要将入选人群局限在低抗凝治疗人群中,在较低的抗凝指标INR(1.5~3.0)的标准中,选取对无华法林治疗相关并发症的患者进行基因筛选,可能对基因筛选的外界条件较苛刻,不能很好地反映华法林治疗的人群的广泛性;(3)忽略了其它基因多态性对华法林维持剂量的影响。对华法林个体剂量差异的研究需从多基因多因素方面出发,同时需要考虑患者的其他临床指标的不同,才能很好的解释个体患者药物稳定剂量的不同的原因[ 6, 7, 8, 9, 10]。
本研究结果显示100名健康人 VKORC1基因是A学位基因的突变率为83.0%。 VKORC1基因GA型患者的华法林维持剂量为(4.51±0.79)mg/d,而AA型的患者华法林维持剂量为(2.59±0.83)mg/d,两者之间差异有统计学意义( P<0.05)。说明 VKORC1(1639G>A)的突变会减少服用华法林的用量,这与其它研究一致。
影响华法林剂量的因素是复杂的。 CYP2 C9 *3和 VKORC1(1639G>A)仅仅是影响华法林稳定剂量基因突变中的2个有代表性基因,而影响华法林稳定剂量的其它因素也与地域和人种有关。基因检测为研究华法林临床治疗个体化提供了分子遗传学数据,并为华法林剂量调整从基因水平方面提供理论依据[ 9, 10, 11, 12, 13, 14]。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|






