通讯作者:李 敏,联系电话:021-52888323。
作者简介:胡绿荫,女,1984年生,学士,主管技师,主要从事白念珠菌流行病学和耐药机制研究。
研究白念珠菌临床分离株唑类耐药和生物膜形成相关基因的表达。
方法收集上海市公共卫生临床中心2006至2011年92例感染性疾病患者[病毒性肝炎、结核、获得性免疫缺陷综合征(AIDS)]血液、无菌部位和黏膜分离鉴定的白念珠菌104株,选用ATB FUNGUS3检测抗菌药物(氟康唑、伊曲康唑和伏立康唑)的最低抑菌浓度(MIC),采用半定量逆转录聚合酶链反应(PCR)分析唑类敏感、浓度依赖性敏感(S-DD)和耐药菌株之间药物外排泵基因
104株白念珠菌中共检测出16株至少对1种唑类药物耐药,6株至少对1种唑类药物S-DD。药物靶酶基因
To investigate the expression of genes related to azole resistance and biofilm formation capability in clinical isolates of
In this study, 104
Among 104 isolates of
The overexpression levels of
白念珠菌是一种机会性感染病原体,它可以感染免疫缺陷患者,引起黏膜白念珠菌病,甚至全身性系统性白念珠菌病[ 1]。随着获得性免疫缺陷综合征(acquired immune deficiency syndrome,AIDS)患者的增多、广谱抗菌药物的应用和侵入性器械的使用,真菌的感染率呈上升趋势。国内报道由真菌引起的医院感染呈明显上升趋势,病原菌以白念珠菌为主[ 2]。自1980年Rosenblatt等[ 3]首次报道念珠菌对酮康唑产生耐药,而后相关耐药的报道越来越多,且呈上升趋势,而唑类药物是临床用于预防和治疗念珠菌病的最广泛的药物,其耐药现象也最严重[ 4]。唑类药物靶蛋白 ERG11基因的突变和高表达,以及外排泵基因 CDR1、 CDR2和 MDR1高表达与唑类耐药的出现相关[ 5, 6, 7, 8],然而还需要进一步数据研究来证实,并明确主导的耐药机制。白念珠菌另外一个重要特征是,它可以在患者体内的导管或生物装置表面以生物被膜的形式黏附生长[ 9]。在感染过程中,与游离态细胞相比,形成生物膜的细胞生长较缓慢且基因表达发生改变[ 10]。生物膜的形成提高了真菌抵抗宿主机体免疫系统和抗菌药物的能力,成为不断产生游离真菌的储藏所。生物膜在耐药性的发生、真菌的压力应答、规避宿主的防御机制和持续性感染中具有重要作用,因此生物膜的形成与真菌的耐药性密不可分[ 10]。其中生物膜相关凝集素样序列蛋白 ALS3基因和菌丝细胞壁蛋白 HWP1基因的表达水平与生物膜形成能力之间的关系亦是一个需要研究的方向。本研究以临床上不同疾病患者的不同感染部位分离的白念珠菌为研究对象,采用逆转录聚合酶链反应(polymerase chain reaction, PCR)检测 CDR1、 CDR2、 MDR1和 ERG11基因的表达水平,以探讨基因表达与唑类耐药之间的关系。同时通过甲基四氮盐[2,3-bis-(2-methoxy-4-nitro-5-sulphenyl)-2H-tetrazolium-5-carboxanilide,XTT]代谢试验筛选强生物膜形成能力(high biofilm formation,HBFs)菌株,研究其与弱生物膜形成能力(low biofilm formation capability isolates,LBFs)菌株相关基因 ALS3和 HWP1表达的差异。
收集上海市公共卫生临床中心医学检验科2006年9月至2011年12月的92例感染性疾病患者(病毒性肝炎、结核和AIDS)无菌部位(血液、胸腹水、支气管灌洗液、导管和中段尿)和黏膜分泌物分离的白念珠菌104株。本实验所有菌株经法国生物梅里埃ATB ID32C 测试板条鉴定后置于20%甘油培养液中-80 ℃保存。
ATB微生物鉴定和药物敏感性系统(法国生物梅里埃公司),96孔细胞培养板(美国Corning),Bio-Tek EXL800(美国Bio-Tek),Nanodrop 2000(美国Thermo),ABI 7500 Real-Time PCR System(美国Applied Bio systems),RPMI 1640(Sigma),XTT(Sigma),lyticase(Sigma),Qiagen RNeasy mini Kit(德国Qiagen),Qiagen QuantiTect Reverse Transcription Kit(德国Qiagen),SYBR Green Master Mix(日本Takara),所用引物合成由Invitriogen公司上海技术服务部完成。
选用法国生物梅里埃公司的ATB® FUNGUS 3试剂条检测其常用抗真菌药物(氟康唑、伊曲康唑和伏立康唑)的最低抑菌浓度(minimal inhibitory concentration,MIC)。
将已活化的白念珠菌的菌株接种于酵母浸膏蛋白胨葡萄糖(yeast extract peptone dextrose medium,YPD)琼脂平板,35 ℃培养24 h, 用接种环挑选一个菌落,接种于5 mL YPD培养液中,于30 ℃恒温摇床(0.5× g)摇菌24 h。菌液离心,去上清,用无菌磷酸盐缓冲液(phosphate buffered saline, PBS)洗2次(400× g),菌液沉渣加1 mL RPMI制成菌液。再用RPMI溶液100倍稀释菌液,使菌液细胞浓度达到1×109/L。加100 μL菌液到96孔细胞培养板中,每个标本重复4个孔,37 ℃培养24 h,同时做空白对照。用无菌PBS清洗培养液和游离细胞,200 μL/孔,重复洗3次,洗完后温箱晾干培养板。待完全晾干后,在每孔加入80 μL XTT-维生素K溶液,37 ℃避光培养2 h后,用加样枪沿每个培养孔的孔壁小心吸取75 μL XTT-维生素K溶液至另一块96孔细胞培养板中,490 nm Bio-Tek EXL800酶标仪读板。HBFs定义为吸光度大于算术平均值加标准差的菌株,而LBFs为吸光度小于算术平均值的菌株。
1. 白念珠菌全RNA 抽提 将已活化的菌种接种至沙保弱平板37 ℃培养24 h,挑取单个菌落接种至5 mL YPD液体培养液中,于30 ℃恒温摇床(0.5× g)摇菌24 h,菌株生长达到平台期。菌液离心,去上清,用无菌PBS洗2次(400× g),用加样枪彻底吸去上清液。 经lyticase法和玻璃珠振荡法联合破真菌细胞壁后,利用Qiagen RNeasy mini Kit试剂盒抽提白念珠菌总RNA,抽提结束,总RNA溶解于50 μL RNase-free water的EP管中。
2. cDNA的合成 在Nanodrop2000分光光度计上检测菌株的RNA标本浓度,校正各菌RNA浓度为1 μg/μL。选用Qiagen QuantiTect Reverse Transcription Kit试剂盒配制14 μL RNA模板溶液,于42 ℃孵育2 min去除基因组DNA,然后配制20 μL的逆转录混合物溶液,42 ℃扩增15 min,95 ℃加热15 min灭活逆转录酶。产物在Nanodrop 2000仪器上检测ssDNA标本浓度,并稀释至5 ng/μL,于4 ℃保存1周。
3. Syber Green荧光定量PCR检测 使用VectorNTⅡ软件设计 CDR1、 CDR2、 MDR1、 ERG11、 ALS3、 HWP1和 ACT1的引物,其中 ACT1为内参基因,见表1。配制25 μL的反应体系: SYBR Master Mix 12.5 μL,目的基因上游引物和下游引物各0.5 μL,标本cDNA 模板溶液5 μL,ddH2O 6.5 μL,每个标本做复孔检测。 将96孔PCR反应板轻柔离心后放入ABI 7500 Real-Time PCR System扩增仪进行扩增。(1)预变性:50 ℃ 2 min;(2)变性:95 ℃ 15 min ;(3)扩增与定量检测:94 ℃ 15 s,55 ℃ 30 s,72 ℃ 32 s,40个循环;(4)熔点曲线:95 ℃ 15 s,60 ℃ 1 min,95 ℃ 15 s,60 ℃ 15 s。选取100、10、1、0.1和0.01 ng/μL的白念株菌基因组标准品绘制CT值-[DNA]0标准曲线。
| 表1 逆转录PCR引物列表 |
采用SPSS 11.0软件进行统计学分析,选用Kruskal-Wallis test检验、Dunn's post hoc analysis分析和Mann-Whitney U test非参数检验,以 P<0.05为差异有统计学意义。
104株白念珠菌中氟康唑耐药株13株,伊曲康唑耐药株16株,伏立康唑耐药株11株。表2中列出了后续耐药机制试验中所研究的38株白念珠菌的药物敏感性结果,其中16株至少对1种唑类药物耐药,6株至少对1种唑类药物浓度依赖性敏感(susceptible dose dependent, S-DD),16株对3种唑类药物均敏感。104株白念珠菌临床分离株中共检测到16株HBFs,同时随机挑选16株LBFs作为对照组。
| 表2 38株白念珠菌对3种唑类药物的药物敏感性结果 |
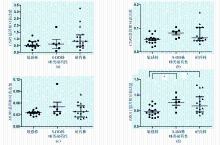
逆转录PCR产物的确定分析显示, CDR1、 CDR2、 MDR1、 ERG11、 ALS3、 HWP1和 ACT1基因的扩增曲线及熔解曲线分析显示,模板的熔解温度比较均一,峰的形状也较锐利,未出现杂峰和主峰的异常增宽,说明试验中未出现污染、引物二聚体和非特异性扩增。唑类敏感、S-DD和耐药菌株的 CDR1、 CDR2、 MDR1和 ERG11基因表达水平见图1,3种菌株的 CDR1基因表达量差异无统计学意义( P=0.092 0), CDR2基因表达量差异无统计学意义( P=0.050 6),MDR1基因表达量差异无统计学意义( P=0.162 2),而 ERG11基因的表达量差异有统计学意义( P=0.007 8)。耐药株与敏感株比较 ERG11基因的表达量差异有统计学意义( P<0.05),S-DD株与敏感株比较差异有统计学意义( P<0.05)。菌丝细胞壁蛋白 HWP1基因在HBFs菌株上出现高表达( P=0.007 9),而凝集素样序列蛋白 ALS3基因在HBFs和LBFs菌株的表达量差异无统计学意义( P=0.299 8)。见图2。
由 CDR1和 CDR2基因编码的Cdrlp和Cdr2p蛋白是细胞膜上的一种外排蛋白,依赖ATP提供能量,外排蛋白的表达增高使得唑类药物被泵出胞外,胞内药物浓度下降[ 11]。由 MDR1基因编码的Mdrlp蛋白为易化扩散载体,是不含ATP结合区的一种多重耐药蛋白,其表达增高将减少药物进入细胞内,胞内药物浓度下降使菌株表现出耐药[ 12]。另外,药物靶蛋白 ERG11基因的高表达也是唑类药物耐药的机制之一[ 4]。尽管一系列的研究表明 CDR1、 CDR2、 MDR1和 ERG11基因在白念珠菌的唑类耐药中发挥着重要作用,但是本次研究证明4种基因在白念珠菌临床分离株的耐药性形成中的重要性并不相同。
本研究发现,随着菌株对唑类药物敏感性的降低, CDR2基因mRNA的表达量呈上升趋势,但 CDR1和 MDR1基因仅是部分S-DD和耐药菌株的mRNA略有上升,菌株总体无上升趋势,差异无统计学意义。而 ERG11基因的S-DD和耐药菌株与敏感株相比有明显的上升趋势,且上升幅度高于前3种基因,差异有统计学意义。本研究证实 ERG11基因的高表达在白念珠菌临床分离株的唑类耐药中占主导地位,同时提示白念珠菌的耐药是多种因素共同作用的结果,该结果与江岑等国内学者的研究相一致[ 13]。
另外,造成真菌体外药物敏感性与临床药效不符、治疗后病程延缓及复发、令医务工作者关注的问题是真菌在人体内常常可以形成生物膜[ 9]。在生物膜形成的第一阶段,细胞壁表面的蛋白质在黏附中起着重要作用,这些蛋白质主要有ALS家族成员和菌丝细胞壁蛋白HWP1。有学者发现 ALS3基因与早期的细丝样细胞的形成相关[ 14],而HWP1/HWP1突变株不能在动物静脉导管模型中形成成熟的生物膜[ 15]。基于 ALS3和 HWP1基因在白念珠菌生物膜形成中的重要性,本次研究采用逆转录PCR检测 ALS3和 HWP1基因的相对表达量。试验发现 HWP1基因在HBFs菌株中表达量显著增高,提示 HWP1基因在生物膜的形成上具有更重要的作用,而 ALS3基因的作用不明显,提示临床上研制抑制 HWP1基因表达的药物可以大大控制菌株在人体内生物膜的形成,降低患者死亡风险。
本研究表明引起白念珠菌耐药的诸多因素中, ERG11基因表达水平的上调占据主导地位,提示 ERG11基因的表达调控机制是今后研究白念珠菌耐药的一个重要方向。另外,菌丝细胞壁蛋白 HWP1基因的高表达与白念珠菌生物膜形成能力增强相关。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|