作者简介:黄永富,男,1971年生,硕士,副主任医师,主要从事生殖医学和临床检验诊断学研究。
为非梗阻性无精子症(NOA)患者筛选出诊断效率高的精子生成标志物,并寻找提高睾丸精子生成标志物诊断效率的有效途径。
方法选取正常生育、梗阻性无精子症(OA)和NOA 3组男性为研究对象,采用酶联免疫和固相化学发光免疫法测定3组男性精浆中的抗缪勒管激素(AMH)浓度、血清促卵泡激素(FSH)和睾酮(T)浓度,采用经阴囊B超声检查法测量睾丸体积(TV),比较这些指标预测NOA患者睾丸精子获取术(TESE)成功与否的性能差异。
结果精浆AMH在区分NOA患者TESE成功与否的准确性、可靠性和诊断价值上均比血清FSH和TV好;血清T的准确性、可靠性和诊断价值均较差;与精浆AMH比较,联合参数的准确性、可靠性和诊断价值均有所提高,但差异无统计学意义(
精浆AMH浓度是一种非侵入性NOA患者持久的精子发生过少的标志物;通过使用联合参数,精浆AMH区分NOA患者TESE成功与否的准确性、可靠性和诊断价值均有所提高。
抗缪勒管激素(human anti-mullerian hormone, AMH)是由睾丸支持细胞分泌的糖蛋白二聚体,有控制睾丸间质细胞增殖和类固醇类激素合成的功能,可能与生殖细胞增殖有关[ 1, 2, 3] 。我们测定并分析了正常生育组、梗阻性无精子症(obstructive azoospermia,OA)组和非梗阻性无精子症(non-obstructive azoospermia,NOA)组3组男性精浆中AMH的浓度,以期判定其是否可作为不育症患者精子发生的标志物和是否可以作为NOA患者睾丸精子获取术(testicular sperm extraction, TESE)成功与否的预测指标。
一、研究对象
在获取知情同意后,收集3组年轻男性的精浆样本,年龄(33±3)岁。根据2010年世界卫生组织的标准,正常生育组20名,年龄(32±3)岁。OA组和NOA组均为2009至2012年期间在南通瑞慈医院不育症门诊就诊的不育症患者。OA组共12例,包括输精管发育不全患者4例、行输精管切除术者5例、输精管梗阻者2例和射精管梗阻者1例,年龄(33±3)岁。NOA组24例,为各种睾丸生精功能不足而核型正常(46,XY)的NOA患者,包括原因不明的NOA患者10例,睾丸接受放化疗者5例,隐睾症者3例,精索静脉曲张者2例,左睾丸切除者1例,病毒性睾丸炎者1例,腹股沟疝者1例,颅咽管瘤术后所致的垂体前叶功能低下者1例,年龄(33±3)岁。3组受试对象的年龄比较差异无统计学意义( P>0.05),具有一定的可比性。
二、仪器与试剂
1. 仪器 Biotek ELX 808 酶标仪和 Biotek ELX 50 洗板机(美国伯腾仪器有限公司);IMMULITE 2000全自动化学发光免疫分析仪(美国西门子医学诊断产品有限公司),WLJY-9000型计算机辅助精子分析系统(北京伟力公司)。
2. 试剂 血清促卵泡激素(follicle stimulating hormone,FSH)和睾酮(testosterone,T)测定试剂盒(批号分别为2309和2465)由美国西门子医学诊断产品(上海)有限公司提供。精浆或血清AMH测定试剂盒(批号20120506)由美国R&D Systems公司提供。WJY-9000型计算机辅助精子分析系统精液常规分析配套试剂(批号20120308)由北京伟力公司提供。
三、方法
1.样本采集 (1)血样采集:研究对象取空腹上午 8∶00至10∶00的前臂浅静脉血5 mL,离心后分离血清,在 8 h 内测定FSH和T浓度;(2)精液采集: 研究对象均禁欲2~7 d,手淫取精于无菌容器中,37 ℃水浴箱中孵育,于射精后1 h内取部分精液样本3000× g离心5 min ,精浆分装到密封管内并迅速于-80 ℃冷冻箱中保存,30 d内测定AMH浓度;(3)睾丸组织采集:局麻下以常规方法进行TESE和睾丸活检术。
2.检测方法 待精液液化后,按世界卫生组织《人类精液检查与处理实验室手册》(第5版)中标准进行精液常规分析。FSH和T测定采用固相化学发光免疫法。FSH、T的最低检测限分别为0.10 IU/L、0.14 nmol/L,检测范围分别为0.1~170 U/L 、0.20~15.86 nmol/L,批内变异系数(coefficient of variation, CV)分别为4.20%、3.38%,批间 CV分别为6.30%、3.75%。AMH水平应用双抗体酶联免疫吸附试验双份重复测定。使用人纯化重组AMH来构建检测方法的标准曲线。最低检测限为3.20 pmol/L,测试范围为3.20~1 071 pmol/L,批内 CV为8%,批间 CV为10%。
3.睾丸体积(testicular volume,TV)测量 用经阴囊B超声检查法进行TV测量。TV以Lambert公式计算:体积(mL)=睾丸上下径×左右径×前后径×0.71。
4. TESE和睾丸病理学检查 在局麻下TESE应与睾丸活检同时进行。取较大侧睾丸,局麻后常规切开至睾丸白膜,避开白膜下血管,睾丸中部切开白膜0.5~1.0 cm,用外科剪刀切开并分离,取约25~50 mg睾丸组织,将其中25 mg睾丸组织放入3 mL HTF-HEPES培养液(Irvine Scientific,Santa Anna,CA,美国)中,将其在培养皿底部的井字划痕上来回搓动以磨碎曲细精管,组织悬液离心10 min后弃上清,加0.2 mL HTF-HEPES。获得的组织悬液作10 μL长滴5个,盖以石蜡油,200倍倒置显微镜检查精子。剩余约25 mg送病理检查,睾丸活检组织在Bouin浸泡液中固定,在石蜡中包埋,切片经苏木精曙红染色,寻找精子生成的证据。根据莱文标准将精子生成分为以下4类:生精功能正常、生殖细胞发育不全或精子生成减少、完全性或不完全性生精阻滞、完全性或不完全性生殖细胞发育不全(唯Sertoli细胞综合征)和曲精小管硬化症。对不同部位每个活检组织的连续切片进行研究,定性分析> 15个曲精小管。
四、统计学方法
采用Analyze-it 2.22软件进行统计分析。数据呈偏态分布,以中位数(M)[第2.5百分位数( P2.5)~第97.5百分位数( P97.5)]表示,采用Mann-Whitney非参数 U检验对不同组间进行AMH、FSH、T和TV的比较, P<0.05为差异有统计学意义。运用该软件绘制受试者工作特征(receiver operating characteristic,ROC)曲线图/曲线决定图,对NOA患者进行各试验指标最佳诊断阈值的确定、ROC曲线下面积(area under ROC curve,AUC)的比较以及各试验指标诊断性能的评估。使用三元一次回归方程计算联合参数,联合参数=TV(mL)+精浆AMH(pmol/L)-FSH/4 (IU/L)。
一、NOA组、OA组及正常生育组TV、血清生殖激素、精浆AMH浓度的比较
NOA组、OA组及正常生育组血清FSH、T及TV、精浆AMH结果见表1。
| 表1 3组受试者的TV,血清FSH、T,精浆AMH结果的分布范围 [M( P2 .5 ~P97.5)] |
二、各实验诊断指标对区分NOA患者TESE成功与否的预期作用
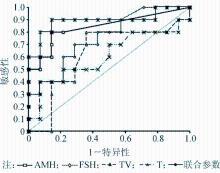
精浆AMH、血清FSH、TV和联合参数用于区分NOA患者TESE成功与否的最佳诊断阈值分别为≥8.60 pmol/L、≤11.3 IU/L、≥12.5 mL和≥18.6。精浆AMH、血清FSH、TV、T和联合参数的AUC分别为0.80、0.70、0.80、0.70和0.90,联合参数的AUC与TV和T之间的差异有统计学意义( P<0.05),精浆AMH的AUC与T之间的差异有统计学意义( P<0.05)。见图1。精浆AMH、血清FSH、TV、T和联合参数的阳/阴性似然比分别为5.60/0.23、2.45 /0.42、2.24/0.31、1.40 /0.60、6.30 /0.12。各实验指标对预测NOA患者TESE成功与否的各种诊断性能参数的评价结果见表2、表3。
| 表2 对血清FSH、T及TV、精浆AMH和联合参数的各准确性参数的评价 |
| 表3 对血清FSH、T及TV、精浆AMH和联合参数的可靠性和诊断价值的评价 |
三、精浆AMH浓度预测睾丸组织活检有无精子的价值
24例NOA患者中有11例可在精浆中检出AMH,其中8例在睾丸组织活检中发现精子,其与精浆AMH浓度有关(浓度为8.60~68.60 pmol/L)
。精浆检测不出AMH的患者有13例,其中11例与睾丸组织活检无精子有关。因此,其可用于精子存在与否的鉴定。精浆AMH的阳性预测值为80.0%,阴性预测值为85.71%,阳性似然比为5.60,阴性似然比为0.23。见表2。
本研究以睾丸活检或TESE证实精子恢复成功为金标准,通过各试验诊断指标的AUC比较显示可能存在:精浆AMH用于预测TESE成功的可能性比血清FSH、T和TV的预测价值更高。联合参数比单独使用精浆AMH、血清FSH和TV这些单项参数的预测价值更高。可以通过联合参数的使用提高单项参数预测NOA患者TESE成功与否的诊断价值。对各试验指标的多项诊断性能参数的比较结果显示,精浆AMH在区分NOA患者TESE成功与否的准确性、可靠性和诊断价值均良好;血清FSH和TV的准确性、可靠性和诊断价值均一般;血清T的准确性、可靠性和诊断价值均差,不具备区分NOA患者TESE成功与否的作用;与精浆AMH比较,联合参数的准确性、可靠性和诊断价值均有所提高,但仍不具有统计学意义( P>0.05)。有关此方面更确切的效果有待日后研究进一步地证实。但可预见多试验指标计算参数的使用和多试验指标诊断试验的联合使用是提高实验诊断指标在诊断试验中准确性、可靠性和诊断价值的有效途径。
本研究结果显示,睾丸起源的高浓度AMH在生育正常组成年男性精浆中可检测到。进入青春期后AMH优先由睾丸支持细胞的顶端向曲细精管腔分泌。这可能与从青春期开始发挥作用的睾丸屏障功能相关。生精上皮周期的特定阶段可能会增强精浆内AMH的分泌[ 4]。事实上,此研究中精浆AMH浓度显著降低与生精功能障碍有关,这也预示AMH分泌与精子生成之间有一定的联系。但我们不能排除AMH浓度的降低可能反映了睾丸支持细胞功能的最初改变,这也将会导致睾丸的生精停滞。AMH是NOA患者持续性精子生成减少的一种非侵入性的标志物。在大多数情况下,对睾丸功能不全男性不育症患者仍知之甚少。无精子症可以是梗阻性的或是分泌性的。后者睾丸产生部分或完全缺乏正常精子的产物,通常与降低的TV和升高的血清FSH浓度有关。睾丸活检可显示不正常的或缺乏的精子生成。目前并没有可用的治疗方案。然而,卵胞浆内单精子注射术(intracytoplasmic sperm injection,ICSI)允许极少量的精子受精,这是最近出现的一个非凡的治疗进展。即使是无精症患者,通过对附睾穿刺或睾丸活检可以产生足够的精子,让显微外科单精子注射技术(microsurgical sperm injection,MESI)或睾丸精子注射技术(testicular sperm injection,TESI)取得成功[ 5]。
尽管临床有TV或血清FSH浓度的参数,睾丸精子恢复有可能发生在>50%的真性NOA病例中[ 6]。在一个独特的随机抽取的睾丸活检组织中存在精子,似乎是目前唯一的预测指标。即使在一侧睾丸活检中发现缺少精子并不能保证在此睾丸中完全没有精子存在[ 7]。尽管初步活检结果为阴性,有43%的分泌性无精子症病例,经重复多次睾丸活检,使得显微注射有足够的睾丸精子恢复,提示睾丸存在局灶性精子生成[ 8]。然而, ICSI必须与女性治疗密切配合,多次反复外科手术治疗是否有心理和经济上的影响,多点活检的长期影响目前仍未得到很好的评价。因此,迫切需要局灶性精子生成减少的客观标记物来指引是否应该进行重复睾丸活检。FSH长期以来一直被认为是一种有效的无精子症的标记物,FSH升高代表精子生成的改变,正常FSH与OA相关[ 9]。事实上,睾丸筛查试验已被越来越多地使用,已清楚表明血清FSH可能不再被认为是一个明确的无精子症的标记物[ 10]。因此,精浆标志物被用来改进对生殖细胞缺乏症的理解,并用来区分精子完全缺乏、精子不完全缺乏等情况。这样的标记物必须是睾丸起源的,在输精管切除术后消失,被支持或生殖细胞以高浓度特别地分泌,与精子发生相关,仍以可检测到的浓度存在于精浆中。已有几种精浆标志物被提出[ 1, 11]。然而,似乎没有一个便捷的既可用于诊断又可用于预后判断的标志物。精浆AMH可以是这样一个有单独预测价值的标记物,因在此研究中睾丸精子似乎主要与可检测到的精浆AMH浓度相关联。然而,一些正常生育男性的精浆内也可检测不到AMH;由于精浆蛋白酶的作用,冻存样本之前的时间长度可能会影响到这些测试结果。在得到最初的否定结果后,AMH用来指引睾丸重复活检,这一初步试验结果必须用多变量分析,经更大规模的试验来证实,并与其他经典的预测指标如TV、血清FSH和精浆抑制素B等相比较[ 8, 9]。
总之,与血清FSH、T浓度和TV等经典的精子生成预测指标相比,精浆AMH浓度在预测NOA患者TESE成功与否的诊断效率更高,在NOA患者中可作为一种非侵入性持久的精子发生过少的标志物,这可在ICSI术前预示睾丸精子恢复成功的可能性。联合参数的使用使精浆AMH在区分NOA患者TESE术成功与否的准确性、可靠性和诊断价值上均有所提高。
(收稿日期:2013-07-15)
(本文编辑:姜 敏)
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|