作者简介:甘 蓉,女,1987年生,硕士,主要从事miR221/222在乳腺癌细胞中作用机制的相关研究。
通讯作者:孟庆贺,联系电话:000196852201。
通过敲低微小RNA(microRNA,miRNA)-221和miRNA-222的表达上调组织金属蛋白酶抑制剂3(TIMP3)的方法来研究人乳腺癌MCF-7细胞系的增殖和迁移能力。
方法根据miRBase数据库中Homo sapiens(hsa)-miRNA-221和hsa-miRNA-222的寡核苷酸序列和一段无义序列分别设计并重组成质粒:反义抑制miRNA-221(antisense-miRNA-221,AS-miRNA-221)、反义抑制miRNA-222(antisense-miRNA-222,AS-miRNA-222)、共同反义抑制miRNA-221/222(antisense-miRNA-221/222,AS-miRNA-221/222)和无义抑制(Scramble),并将其分别利用脂质体LipofectamineTM2000转染进人乳腺癌MCF-7细胞中,经G418筛选后建立稳定表达的对照细胞株[未转染正常细胞(Control组)和无义抑制细胞(Scramble组)]和低表达miRNA-221、miRNA-222细胞株(即AS-miRNA-221组、AS-miRNA-222组和AS-miRNA-221/222组)。转染24 h后于荧光显微镜下观察转染效率;采用实时荧光定量聚合酶链反应(PCR)检测各组细胞中miRNA-221和miRNA-222的表达量,采用逆转录PCR检测各组细胞中质粒载体上携带的抗性
转染24 h之后,在荧光显微镜下观察到各转染组细胞的绿色荧光蛋白表达较多,即转染效率较高。检测转染后各组细胞中
通过敲低miRNA-221、miRNA-222、上调TIMP3表达可以抑制人乳腺癌细胞系MCF-7的增殖和迁移能力。
To study the proliferation and migration abilities of human breast cancer MCF-7 cell line through knocking down microRNA (miRNA)-221 and miRNA-222 expressions and up-regulating tissue metalloproteinase inhibitor 3 (TIMP3).
MethodsAntisense-miRNA-221(AS-miRNA-221), antisense-miRNA-222(AS-miRNA-222), antisense-miRNA-221/222(AS-miRNA-221/222) and scramble were designed based on Homo sapiens (hsa)-miRNA-221 and hsa-miRNA-222 oligonucleotide sequence and nonsense sequence in miRBase. LipofectamineTM2000 was used to transfect AS-miRNA-221, AS-miRNA-222, AS-miRNA-221/222 and scramble into MCF-7 cell line . They were classified into control groups with stable expression [untransfected normal cell group(Control group) and scramble group(Scramble group)] and down-regulated miRNA-221 and miRNA-222 groups(AS-miRNA-221 group, AS-miRNA-222 group and AS-miRNA-221/222 group), respectively, according to G418 screening. After transfecting for 24 h, transfection efficiency was determined by fluorescence microscopy. Real-time fluorescence quantitation polymerase chain reaction (PCR) was used to determine the expressions of miRNA-221 and miRNA-222. The
After transfecting for 24 h, there was an increasing expression of green fluorescence, and the transfection efficiency was high. The expressions of
Through up-regulatingp TIMP3, knocking down miRNA-221 and miRNA-222 can inhibit the proliferation and migration of human breast cancer MCF-7 cell line.
微小RNA(microRNA,miRNA)在生物体生长发育和细胞增殖、分化、凋亡以及人类各种疾病的发生、发展过程中发挥重要的调控作用。随着miRNA功能研究的不断开展,越来越多的研究表明miRNA的异常表达调控与肿瘤的发生密切相关[ 1, 2, 3]。miRNAs是长度约21~25个核苷酸的非编码RNA,通过与靶基因mRNA的3' 非转录区(3'untranslate dregion,3'UTR)完全或不完全匹配结合,使miRNA抑制mRNA翻译或降解mRNA,从而抑制其表达。Zhang等[ 4]在研究色素性视网膜炎(retinitispigmentosa,RP)时发现miRNA-221、miRNA-222基因序列的存在。研究结果显示miRNA-221、miRNA-222在人乳腺癌MCF-7细胞中是过度表达的[ 5, 6, 7]。人的miRNA-221、miRNA-222核心种子序列(68~72)完全同源,miRNA-221和miRNA-222基因序列定位于Xp11.3,二者呈前后排列,同时由于二者种子序列完全同源以致它们会有许多相同的靶基因。其中,组织金属蛋白酶抑制剂3(tissue metalloproteinase inhibitor 3,TIMP3)已被证实是miRNA-221和miRNA-222的靶基因[ 8, 9],而且miRNA-221和miRNA-222的异常调节会使TIMP3的表达降低,从而失去抑制金属蛋白酶的能力[ 10],导致肿瘤细胞的过度增殖和远处迁移。金属蛋白酶家族(adisintegrin and metalloprotease,ADAMs)在调节肿瘤细胞的微环境中起着重要的作用,如参与跨膜蛋白的水解、细胞黏附和信号传导等[ 11],同时通过降解细胞外基质导致肿瘤浸润和转移。在ADAMs家族中,了解最清楚的是ADAM17。ADAM17受TIMP3的调节,且干扰其表达,可以降低细胞增殖、黏附和迁移能力,并使凋亡增加[ 12]。然而,miRNA的特异性调节和生物功能大部分还不清楚。我们结合上述文献结论,通过下调人乳腺癌MCF-7细胞中miRNA-221、miRNA-222的表达,上调TIMP3水平来研究MCF-7细胞的增殖和迁移能力。
一、材料和试剂
1.材料 人乳腺癌体外细胞系MCF-7购自中国科学院上海细胞生物学研究所中国科学院细胞库。反义miRNA-221、反义miRNA-222和无义随机对照质粒购自上海吉玛制药公司。反义miRNA-221序列:5'-AGCUACAUUGUCUGCUGG-GUUUC-3';反义miRNA-222序列:5'-AGCUACAUCUGGCUACUGGGU-3';无义对照序列:5'-AGCTTGTCGACTTCAACAAAAAAGGG-3'[ 13]。
2.试剂 RPMI 1640培养基和胎牛血清购自美国Gibco公司,LipofectamineTM2000和Trizol购自美国Invitrogen公司,细胞计数试剂盒(CCK-8)购自日本同仁公司,PrimeScript П1st Strand cDNA Synthesis Kit、Ex Taq酶、SYBR® Premix Ex TaqTM Ⅱ(Perfect Real Time)购自日本TaKaRa公司,BCA蛋白浓度测定试剂盒及十二烷基硫酸钠(sodium dodecyl sulfate,SDS)-聚丙烯酰胺凝胶电泳(polyacrylamide gel electrophoresis,PAGE)凝胶配制试剂盒购自碧云天生物技术研究所,ADAM17兔多克隆抗体购自美国Bioword公司,β-肌动蛋白(β-actin)鼠多克隆抗体购自碧云天生物技术研究所,其他试剂均为国产分析纯试剂配制。
二、细胞培养和稳定转染细胞株构建及鉴定
1.细胞培养和稳定转染细胞株构建 MCF-7细胞培养与转染方法见文献[14]。MCF-7细胞用含10%胎牛血清的RPMI1640培养基于37 ℃、5%CO2培养箱中培养。转染前24 h以每孔2×105个/mL浓度接种于12孔培养板中,待细胞汇合度达80%左右时,利用LipofectamineTM2000将无义质粒、反义miRNA-221质粒和反义miRNA-222质粒转染MCF-7细胞[ 15]。按转染质粒的不同将细胞株分为未转染正常细胞(Control)组、无义抑制(Scramble)组、反义抑制miRNA-221(antisense-miRNA-221,AS-miRNA-221)组、反义抑制miRNA-222(antisense-miRNA-222,AS-miRNA-222)组、反义抑制miRNA-221/222(antisense-miRNA-211/222,AS-miRNA-221/222)组。转染8 h后,更换为选择培养基(含800 μg/mL G418和10%胎牛血清的RPMI1640培养基)进行培养,隔天换液,2周后出现抗性克隆,挑单克隆再以400 μg/mL维持量的G418扩大培养,建立稳定转染的细胞系。转染方法参考LipofectamineTM2000试剂盒说明书,在转染24~48 h内于荧光显微镜下观察绿色荧光表达情况,估计转染效率。
2.总RNA抽提 按照试剂说明书,将Control组、Scramble组、AS-miRNA-221组、AS-miRNA-222组和AS-miRNA-221/222组细胞用Trizol试剂提取总RNA,Nanodrop紫外分光光度计检测所提总RNA的浓度和纯度。
3.稳定转染Scramble、AS-miRNA-221、AS-miRNA-222和AS-miRNA-221/222细胞的鉴定 neo基因是G418的抗性筛选标志,通过聚合酶链反应(polymerase chain reaction,PCR)检测 neo基因可以鉴定转染效果。提取上述稳定转染细胞和Control组细胞的总RNA,合成 neo基因引物,上游引物序列:5'-TCTGATGCCGCCGTGTT-3';下游引物序列:5'- GATGTTTCGCTTGGTGGTC-3'。扩增产物为324 bp;以甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)为内参照,其引物序列上游为5'-CCATGGAGAAGGCTGGG-3',下游为5'-CAAAGTTGTCATGGATGACC-3',PCR产物为402 bp。逆转录反应条件:42 ℃ 30 min,85 ℃ 5 min;PCR反应条件:94 ℃预变性4 min 50 s;94 ℃ 30 s,53.2 ℃ 30 s,72 ℃ 30 s ,共进行35个循环;最后72 ℃延伸10 min。1.5%琼脂糖凝胶电泳,由Bio-Rad凝胶成像仪摄取凝胶图像,用Quantity One软件进行半定量分析,实验重复3次。
4. 实时荧光定量PCR检测转染后miRNA-221和miRNA-222的表达 采用实时荧光定量PCR验证转染是否成功。操作按试剂盒说明书进行,同时参照Chen等[ 16]的方法。采用U6作为内参照,进行归一化。
三、实时荧光定量PCR检测TIMP3的表达
用Trizol试剂进行各组细胞总RNA的抽提,采用一步法进行逆转录反应,采用实时荧光定量PCR检测转染后TIMP3基因的表达情况。具体步骤按试剂盒说明书进行。逆转录反应条件:42 ℃ 30 min,85 ℃ 5 s,4 ℃ 30 min。实时荧光定量PCR反应条件:95 ℃ 30 s,95 ℃ 5 s,56.4 ℃ 30 s,共40个循环。TIMP3引物序列上游为5'-AGTTACCCAGCCCTATGA-3',下游为5'-GCAAAGGCTTAAACATCT-3',PCR产物为318 bp;以GAPDH为内参照,其引物序列上游为5'-GAACATCATCCCTGCCTCTACT-3',下游为5'-CCTGCTTCACCACCTTCTTG-3',PCR产物为208 bp。实验重复3次。
四、蛋白提取和免疫印迹法检测ADAM17的表达
用冰预冷的RIPA细胞裂解液裂解Control组、Scramble组、AS-miRNA-221组、AS-miRNA-222组和AS-miRNA-221/222组细胞。测定蛋白浓度后,取50 μg蛋白上样,经10%SDS-PAGE电泳后转膜1.5 h,室温封闭2 h,加入一抗稀释液(ADAM17:1∶800;β-actin:1∶1 000),4 ℃过夜;TBST洗4次(每次5 min)后加二抗稀释液(1∶5 000),于37 ℃孵育1~2 h,用TBST洗4次(每次10 min)后 ,Supersignal Protein Detection Kit增强化学发光(ECL)显色,由Bio-Rad凝胶成像仪摄取凝胶图像,用Quantity One 软件分析吸光度( A)值,ADAM17的表达以ADAM17的 A值与β-actin的 A值的比值表示。实验重复3次。
五、绘制生长曲线观察敲低miRNA-221和miRNA-222后MCF-7细胞的生长情况
取生长对数期的各组MCF-7细胞,消化、计数,以 3×103个/mL的密度接种入96孔板中,每孔100 μL,每组设3个平行孔,于37 ℃、5%CO2培养箱中培养4 h,待细胞贴壁后,更换新鲜的培养基100 μL,再加入CCK-8液10 μL,37 ℃孵育1 h,用酶标仪测量450 nm处的 A值。连续监测8 d,绘制生长曲线。实验重复3次。
六、采用划痕修复实验检测敲低miRNA-221和miRNA-222后MCF-7细胞的迁移能力
取生长对数期的各组MCF-7细胞,消化、计数,以 5×105个/mL的密度接种入24孔板中,每孔500 μL,培养4 h,待细胞贴壁后用小枪头沿着每孔偏中线两侧划痕,划痕应较直且宽度较一致,用PBS清洗一遍,确保清洗掉痕线上散在的细胞,每组设3个平行孔,加入含2%胎牛血清的RIPA1640培养液再放入培养箱内培养24、48、72 h,分别于每个时间点观察细胞向中间迁移的情况并在显微镜下拍照记录。注意每次拍照的位置应固定,且每次拍照前用PBS洗2遍以去除漂浮的死细胞。计算闭合率以反映细胞的迁移能力。闭合率(%)=(迁移距离/划痕距离)×100%。
七、统计学方法
使用SPSS 17.0软件进行统计分析。数据的方差分析采用 F检验,样本间的两两比较采用LSD- t检验。 P<0.05为差异有统计学意义。
一、稳定转染细胞株构建及鉴定
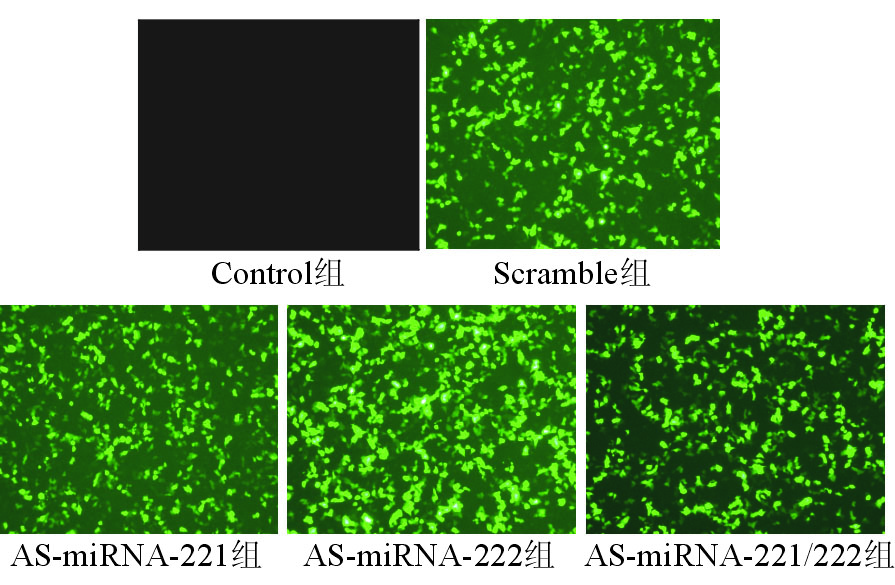
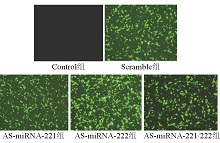
1.细胞转染及荧光观察结果 将质粒转染入细胞后24~48 h,于荧光显微镜下观察绿色荧光蛋白的表达情况。转染后Scramble组、AS-miRNA-221组、AS-miRNA-222组和AS-miRNA-221/222组表达绿色荧光的细胞数量较多,转染效率均高于70%,而未转染细胞无绿色荧光表达。见图1。
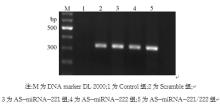
2.稳定转染细胞株中 neo基因的检测 经G418筛选5周后挑取单克隆,最终获得稳定表达的细胞。采用逆转录PCR鉴定稳定细胞株中G418选择性标记 neo基因的表达情况。琼脂糖凝胶电泳显示扩增产物约为324 bp,见图2。Scramble组、AS-miRNA-221组、AS-miRNA-222组、AS-miRNA-221/222组中 neo基因表达明显升高,表明质粒已转染进MCF-7细胞基因组中。
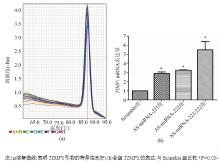
3.实时荧光定量PCR检测转染后miRNA-221和miRNA-222的表达 通过2-ΔΔCt方法分析转染后miRNA-221、miRNA-222的表达水平。以U6为参照,AS-miRNA-221组miRNA-221相对表达量为0.680±0.030, AS-miRNA-221/222组为0.367±0.020,Scramble组为1;3组之间差异均有统计学意义( P均<0.05)。AS-miRNA-222组miRNA-222相对表达量为0.790±0.040,AS-miRNA-221/222组为0.410±0.040,Scramble组为1;3组之间差异均有统计学意义( P均<0.05)。见图3。由此可见,转染质粒的DNA已整合到MCF-7细胞基因组中。
二、实时荧光定量PCR检测 TIMP3基因的表达水平
实时荧光定量PCR检测 TIMP3基因的表达结果见图4。miRNA-221和miRNA-222的表达下调后,AS-miRNA-221组、AS-miRNA-222组和AS-miRNA-221/222组 TIMP3基因表达与Scramble组相比明显增强( P<0.05)。
三、蛋白提取和免疫印迹法检测结果
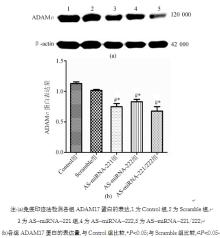
免疫印迹法结果见图5。与Control组和Scramble组比较,AS-miRNA-221组、AS-miRNA-222组和AS-miRNA-221/222组中的ADAM17蛋白表达下调( P<0.05);而Scramble组与Control组之间差异无统计学意义( P>0.05)。表明反义抑制miRNA-221和miRNA-222后能在翻译水平降低ADAM17蛋白的表达;而共同抑制miRNA-221/222表达并未发挥联合作用,使ADAM17表达明显降低。
四、绘制生长曲线观察敲低miRNA-221和miRNA-222后MCF-7细胞的生长情况
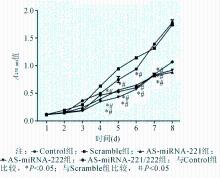
从生长曲线可以看出,与Control组和Scramble组比较, AS-miRNA-221、AS-miRNA-222和AS-miRNA-221/222组细胞的生长能力明显受到抑制,尤其是第5、6、7、8 d的差异均有统计学意义( P<0.05);而Control组和Scramble组之间差异无统计学意义( P>0.05),AS-miRNA-221、AS-miRNA-222和AS-miRNA-221/222组之间差异均无统计学意义( P>0.05),见图6。由此可见,降低miRNA-221、miRNA-222的表达能抑制MCF-7细胞的生长能力。
五、敲低miRNA-221和miRNA-222后MCF-7细胞的迁移能力
分别于24、48、72 h观察各组细胞的划痕修复情况。AS-miRNA-221、AS-miRNA-222和AS-miRNA-221/222组MCF-7细胞的迁移能力被抑制,尤其48 h后各组的迁移能力明显受到抑制,差异有统计学意义( P<0.05),见表1和图7。
| 表1 各组细胞在不同时间段的闭合率 (%) |
miRNA起源于内源性表达转录本,是最近的研究热点。目前对其功能的研究主要通过在特定细胞或组织外源性过表达或抑制目的miRNA后检测其引起的相关生理学或病理学变化。其中,外源性抑制miRNA的方法主要为基因水平抑制miRNA表达。例如,条件性敲除miRNA加工因子Dicerl,可得到所有成熟miRNA的缺失体;使用反义核酸分子抑制miRNA表达[ 17],此类修饰物包括2'-O甲基修饰物、LAN修饰物、anti-miRNA抑制剂等。
miRNA可以直接调控细胞分化和凋亡影响肿瘤的发生,也可以通过作用于癌基因或抑癌基因间接影响肿瘤的发展。miRNA对靶基因的调控作用可以是一对多的,即一个miRNA可以调控多个靶基因;也可以是多对一的,即多个miRNA作用于一个靶基因。其中, TIMP3是miRNA-221和miRNA-222的一个靶基因[ 8, 9],而miRNA-221和miRNA-222与 TIMP3的互补程度决定了靶基因mRNA 或者在翻译水平被部分抑制,或者完全断裂,从而调控其表达[ 18]。乳腺癌细胞中 TIMP3表达的变化是调节ADAM17活性和促有丝分裂的信号,与肿瘤的多种生理过程都相关,如细胞增殖、迁移等。
本研究按照文献[ 13]报道的方法敲低MCF-7细胞中miRNA-221和miRNA-222的表达,并经实时荧光定量PCR检测证实,从而构建低表达miRNA-221和miRNA-222的稳定细胞株,上调 TIMP3的表达,抑制ADAM17的活性,以此来探讨乳腺癌MCF-7细胞的增殖和迁移能力。本研究选用的载体为pEX-5质粒,该质粒带有新霉素抗性 neo基因,可用于真核生物的筛选。此外,还带有一个 EGFP基因,便于对质粒转染和稳定筛选采用直接观察。通过转染人乳腺癌MCF-7细胞并经G418筛选获得了可靠的稳定低表达miRNA-221和miRNA-222的细胞株。实时荧光定量PCR结果显示稳定细胞株中miRNA-221和miRNA-222的表达明显降低,表明建株成功。有意思的是,共同抑制miRNA-221/222较单独抑制miRNA-221或miRNA-222效果更显著。此后,在稳定细胞株基础上进行实时荧光定量PCR检测其靶基因 TIMP3的表达,结果发现低表达miRNA-221、miRNA-222的细胞株中 TIMP3 mRNA的表达明显升高。免疫印迹法证实miRNA-221、miRNA-222被敲低后可明显下调ADAM17的表达,但单独抑制与共同抑制之间差异无统计学意义( P>0.05),即共同抑制miRNA-221和miRNA-222表达并未发挥联合作用,使 TIMP3和ADAM17的表达明显改变。生长曲线显示,在下调miRNA-221、miRNA-222的表达,上调 TIMP3表达的情况下,可以降低MCF-7细胞的增殖能力。划痕修复实验结果显示,在最初的时间段里抑制细胞迁移不明显,但随着时间的延长,低表达miRNA-221、miRNA-222细胞的迁移能力被明显抑制。因此,改变miRNA-221、miRNA-222的表达可以通过调节 TIMP3-ADAM17通路,抑制MCF-7细胞的增殖和迁移能力。但是单纯反义miRNA-221、miRNA-222处理与反义miRNA-221/222联合作用在减弱细胞的增殖和迁移能力上未见明显差异。由此可见,虽然本研究构建的共转染抑制显著改变了miRNA-221/222的表达,但并未在功能方面发挥预期的联合增强作用,这可能与反义抑制的效果相关,在今后的研究中可能需要更加致力于研究如何显著降低miRNA-221/222的表达,进而发挥其抑癌作用。总之,通过敲低miRNA-221、miRNA-222的表达,上调 TIMP3,进而影响ADAM17的表达可以抑制人乳腺癌MCF-7细胞的增殖和迁移能力。
在过去的几十年里,许多学者致力于研究miRNAs与肿瘤的增殖、侵袭、迁移能力。长期的研究证实了几种不同的生长因子信号通路。其中下调miRNA表达的辅助分子信号、识别潜在的靶定多基因和调节数个生物通路、抑制肿瘤相关基因的表达一直是研究新型抗肿瘤疗法的一个重要思路,其前提是找到与肿瘤的发生和侵袭转移密切相关的靶基因。本研究结果显示低表达miRNA-221、miRNA-222,调节 TIMP3-ADAM17水平能抑制人乳腺癌MCF-7细胞的增殖和迁移。
(收稿日期:2013-11-01)
(本文编辑:龚晓霖)
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|