作者简介:蓝海舰,男,1973年生,主管技师,主要从事细胞形态学检验工作。
为诊断微小分化型急性髓细胞白血病(AML-M0)提供现实依据。
方法报告一例骨髓增生异常综合征(MDS)转化为AML-M0的临床过程。
结果MDS虽经有效治疗,但多数仍转化为白血病,其中以AML为主。
结论AML-M0的诊断在细胞形态学及化学染色的基础上必须应用细胞表型免疫分析等现代手段确诊。
To provide realistic reference for the diagnosis of minimal differentiation type of acute myelocytic leukemia (AML-M0).
MethodsThe clinical process of a case of myelo-dysplastic syndrome (MDS) transformed into AML-M0 was reported.
ResultsAlthough MDS was performed for effective treatment, the most were still transforming into leukemia, mainly AML.
ConclusionsThe diagnosis of AML-M0 based on cell morphology and chemical staining must use the cell immunophenotype analysis and other modern means.
骨髓增生异常综合征(myelo-dysplastic syndrome, MDS)是一组获得性的、造血功能严重紊乱的、造血干细胞克隆性疾病。这种异常的干细胞克隆以失调和低效的方式分化成熟,导致终末血细胞数量减少、功能及形态异常,这一克隆最终可丧失分化成熟能力而演变成急性白血病[绝大多数为急性髓细胞白血病(acute myelocytic leukemia, AML)],极少数为急性淋巴细胞白血病(acute lymphoblastic leukemia, ALL)[ 1]。本例患者于2009年8月诊断为MDS,病情反复发作,病程较长,多次入院化疗,但2012年8月患者转化为微小分化型AML(AML-M0),此白血病较少见,1991年由FAB协作组命名为AML-M0型,属AML的一个新型,约占AML的2%~3%,多见于老年人[ 2]。是一种以原始粒细胞异常增生并分化成熟障碍为特征的血液恶性肿瘤,该病化疗不敏感,疗效较差,生存期短。
1.病史
患者男,79岁,汉族。于3年前无明显诱因出现全身乏力、贫血,就诊于莒县人民医院并确诊为“MDS”,并多次入莒县人民医院血液科应用康力龙、支持疗法及输血治疗,效果可,以后病情稳定,无心慌,无头晕、头痛,无咯血及胸痛,无恶心、呕吐,无尿血、尿痛,近3 d来出现乏力,伴有头晕,为进一步诊治遂来莒县人民医院就诊。既往有肾移植手术史,具体时间、情况及治疗不详,无高血压病、糖尿病等病史,无病毒性肝炎、结核等传染病及密切接触史,无重大外伤史,有输血史,无输血反应,无药物及食物过敏史,预防接种史不详,生于原籍,无外地、疫区久居史,无工业毒物、放射线长期接触史,无重大精神创伤史,无吸烟、饮酒史。适龄结婚,育有1子3女,配偶及子女均体健,否认家族中有传染病、肿瘤病及遗传性疾病史。
2.体格检查
体温36.2 ℃;心率80次/min;呼吸20次/min;血压13.3/8.0 kPa,;老年男性,发育正常,营养中等,神志清,精神差,自主体位,查体合作。全身皮肤黏膜无黄染,全身浅表淋巴结无肿大。头颅无畸形, 贫血貌,眼睑及结膜无水肿,结膜苍白,巩膜无黄染,双侧瞳孔等大等圆,对光反射灵敏,耳鼻喉无异常,颈软对称,颈静脉无怒张,气管居中,甲状腺无肿大,未闻及异常血管杂音。胸廓对称无畸形,胸骨无压痛,肺部叩诊清音,双肺呼吸音清,未闻及干湿性罗音。心前区无异常隆起,心浊音界不大,心音正常,心律规整,各瓣膜区无病理性杂音,腹软,无压痛、反跳痛,肝脾肋下未及,移动性浊音阴性,肠鸣音正常。肛门、直肠、外生殖器未查。脊柱四肢无畸形,运动无障碍,生理反射正常,无病理反射。
3.辅助检查
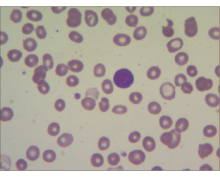
(1)血液分析:白细胞8.83×109/L,中性粒细胞0.187,淋巴细胞0.810,单核细胞0.010,嗜酸性粒细胞0.020,血红蛋白43 g/L,红细胞1.42×109/L,红细胞压积14%,平均红细胞体积98.6 fL,红细胞平均血红蛋白量30.3 pg,红细胞平均血红蛋白浓度307 g/L,血小板38×109/L,网织红细胞计数0.013。肝功、肾功、血脂、血糖及心肌酶无明显异常;(2)本室外周血液涂片:白细胞总数正常,原始细胞53%,胞体较小,规整,胞浆量极少,呈淡蓝色,无颗粒及奥氏小体,胞核圆形,核仁清楚,多为1个核仁。成熟红细胞形态大致正常,血小板少见,未查见其它特殊病理细胞及寄生虫。外周血液涂片见图1:
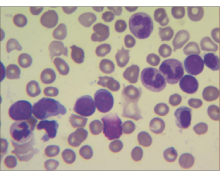
骨髓涂片:按FAB分型采用细胞形态学及细胞化学染色诊断白血病及分型。骨髓穿刺、涂片及染色均满意,骨髓有核细胞增生活跃,见图2:
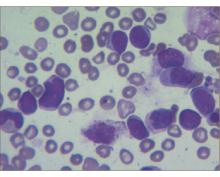
原始细胞占35%,胞体较小,规整,胞浆量极少,呈淡蓝色,无颗粒及奥氏小体,胞核圆形,核仁清楚,多为1个核仁,见图3、图4:
有核红细胞增生减低,占15%,各期细胞均见,部分幼红细胞呈类巨幼样变。成熟红细胞大小不等,片尾较多的涂抹细胞,全片见巨核细胞9个,血小板少见。细胞化学染色及苏丹黑B染色阴性。遂拟诊断为急性白血病(AML?;ANLL?),建议细胞表型免疫分析,明确白血病分型。
4.会诊结果
患者第2天到上级医院会诊,外周血象原始细胞占49%,骨髓原始细胞占36%,细胞表型免疫分析:幼稚细胞占40%;CD34 75%;CD117 81%;CD13 39%;髓过氧化物酶阴性;B淋巴系CD10、CD19、CD20均不表达,T淋巴系CD2、CD3、CD5均为阴性。结合临床、细胞形态及化学染色、细胞免疫分型分析,诊断为AML-M0。
MDS过去由于临床表现、血象及骨髓象表现差异性较大,疾病转归不同,在医学文献中曾出现诸多病名,给诊断及治疗造成极大的不便。1982年的FAB协作组基于细胞形态标准分为难治性贫血(RA)、环形铁粒幼细胞难治性贫血(RARS)、原始细胞过多难治性贫血(RAEB)、转化中的原始细胞过多难治性贫血(RAEB-T)、慢性粒-单核细胞白血病(CMMOL)五型[ 1]最为经典,被世界各国广为接受。2008年世界卫生组织进行了最新修订,分为难治性血细胞细胞减少伴1系发育异常(RCUD)、难治性血细胞减少伴多系发育异常(RCMD)、难治性贫血伴原始细胞增多1型(RAEB-1)、难治性贫血伴原始细胞增多2型(RAEB-2)、MDS-不能分类(MDS-U)、MDS伴孤立5 q 丢失(MDS 5q-)[ 3],增加了细胞免疫表型分析及染色体检查,使MDS的分型更细化,更为合理,对临床的诊治起到了重要作用。MDS的最终转化多为AML,本病例从MDS-RA转化为AML-M0,此白血病在1987年由Lee等提出,是一种分化极低的骨髓细胞恶性增殖性疾病。该病发病率低,占AML的2%~3%,其特点为从细胞形态学不能分型,常规细胞化学染色阴性,无奥氏小体,免疫表型有髓系分化抗原,超微结构髓过氧化物酶阳性,不表达T和B淋巴系的分化抗原。该型多见于老年人,肝脾淋巴结肿大不明显,疗效差,生存期短[ 2]。1991年FAB协作组将M0归入AML,详尽叙述了白血病细胞形态学特征,规定细胞化学染色及苏丹黑B染色<3%。免疫表型有1个或多个髓系相关抗原表达而B/T淋巴细胞抗原为阴性[ 4]。国内重新修订了诊断标准:异常增生细胞在形态学上呈原始细胞特征,≥20%。胞浆大多透亮或中度嗜碱,无嗜天青颗粒及奥氏小体,核仁明显,类似ALL-L2型。细胞化学染色及苏丹黑B染色阳性率<3%;免疫学检验显示髓系标志CD33和/或CD13可阳性,淋系抗原阴性,分别有CD7、末端脱氧核苷酸转移酶阳性;电镜:髓过氧化物酶阳性[ 5]。
本例患者MDS 3年余,无发热、出血及肝脾淋巴结肿大,一般情况尚可,但外周血象原始细胞占72%,骨髓内原始细胞占35%,胞体较小,规整,胞浆量极少,呈淡蓝色,无颗粒及奥氏小体,胞核圆形,核仁清楚,多为1个核仁,过氧化物酶及苏丹黑B染色阴性,因检查手段有限,加之经验不足,不能明确白血病的类型,但采用流式细胞仪进行细胞免疫表型分析,确定髓系细胞抗原表达,应诊断为AML-M0。此病做细胞表型免疫分析及电镜检查,具有重大的诊断价值。
AML-M0单纯从细胞形态、化学染色诊断是不可能的,极易与ALL相混淆。建议对白血病诊断应结合免疫表型分析,甚至在患者经济允许的情况下,充分利用电镜、染色体及基因分析提高少见白血病的诊断率,减少误诊。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|