作者简介:蒯守刚,男,1975年生,硕士,主管技师,主要从事临床微生物检验工作。
通讯作者:邵海枫,联系电话:0510-80219555-3203。
研究一株临床分离的碳青霉烯类药物耐药产气肠杆菌的耐药机制和耐药基因传播机制。
方法采用琼脂稀释法检测菌株对抗菌药物的最低抑菌浓度(MIC), 采用质粒接合试验、质粒提取、DNA 分子杂交、等电聚焦电泳(IEF)、聚合酶链反应(PCR)、DNA测序和外膜蛋白分析研究菌株的耐药基因及其传递机制。
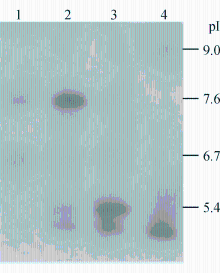
结果IEF显示临床分离的产气肠杆菌株含有3条β-内酰胺酶条带, 等电点(pI)分别为5.4、6.7和7.8。PCR扩增及测序结果表明它们分别为TEM-1(pI 5.4)、KPC-2(pI 6.7)、DHA-1(pI 7.8) β-内酰胺酶。 接合菌含有2条β-内酰胺酶条带,pI为6.7和7.8。接合试验、质粒提取和分子杂交试验结果显示
产气肠杆菌分离株对碳青霉烯类抗菌药物耐药可能由A类2f组KPC-2酶介导,DHA-1酶合并外膜蛋白缺失也可能与碳青霉烯类药物耐药机制形成有关。
To investigate the resistance and transmission mechanisms of a clinical isolate of carbapenem-resistant
The minimal inhibition concentrations (MIC) of antimicrobial agents were determined by agar dilution method, and plasmid conjugation experiment, plasmid extraction and DNA molecular hybridization, isoelectric focusing electrophoresis (IEF), polymerase chain reaction (PCR), DNA sequencing and outer-membrane protein analysis were used for analyzing the resistant gene and transmission mechanism.
ResultsIEF showed that there were 3 bands of beta-lactamases with isoelectric point (pI) of 5.4, 6.7 and 7.8 in the clinical isolate of carbapenem-resistant
The clinical isolate of
肺炎克雷伯菌碳青霉烯酶( Klebsiella pneu-moniae carbapenemases, KPC)是最为常见的A类碳青霉烯酶,最早从肺炎克雷伯菌中检出,随即在肠杆菌科细菌多个种属,包括大肠埃希菌、阴沟肠杆菌、产气肠杆菌、产酸克雷伯菌、黏质沙雷菌、肠杆菌属、弗氏柠檬酸杆菌属、沙门菌属、拉乌尔菌属、奇异变形杆菌、霍氏肠杆菌,均有检出KPC酶的报道[ 1, 2, 3]。我们对从临床微生物实验室分离的一株对碳青霉烯类抗菌药物耐药的产气肠杆菌的耐药机制和耐药基因传递方式进行分析探讨。
1. 菌株来源
碳青霉烯类药物耐药的产气肠杆菌分离株 E.aero.24于2007年7月3日分离自重症监护病房(intensive care unit,ICU)69岁重症肝病患者的痰标本。采用VITEK-32全自动微生物分析仪进行鉴定和药物敏感性试验。质控菌株为大肠埃希菌(ATCC 25922)和肺炎克雷伯菌(ATCC 700603)。利福平耐药大肠埃希菌600 (LacZ- NalR RifR)为质粒接合试验受体菌(由浙江大学附属邵逸夫医院俞云松教授惠赠)。
2. 仪器与试剂
聚合酶链反应(polymerase chain reaction ,PCR)扩增仪为德国Eppendorf公司产品; Bio-Rad电泳和凝胶成像分析系统为美国Bio-Rad公司产品; Taq DNA聚合酶、dNTPs为日本TaKaRa公司产品; PhastGel IEF3-9为瑞典Amersham Biosciences公司产品; PCR产物纯化、凝胶回收试剂盒及质粒抽提试剂盒为德国QIAGEN公司和上海申能博彩生物科技有限公司产品; 水解酪蛋白 和Luria-Bertani培养基为英国Oxid公司产品; 抗菌药物纸片为英国Oxid公司产品。
1. 接合试验
受体菌为利福平耐药的大肠埃希菌600。挑取临床分离株和受体菌单个菌落接种于2 mL LB肉汤,37 ℃摇床180 r/min培养4 h。 取供体菌和受体菌液0.5 mL置于1.5 mL U型管中混匀,37 ℃静置培养4 h。 取混合菌液100 μL均匀涂布于含抗菌药物的水解酪蛋白胨平板(含1 μg/mL美罗培南和256 μg/mL利福平)。37 ℃静置培养14 h后挑取单个克隆再次移种含复合抗菌药物的平板过夜培养, 然后制备菌株DNA模板并采用PCR扩增进行阳性接合子的验证。
2. 质粒提取和质粒DNA分子杂交试验
碳青霉烯类药物耐药的产气肠杆菌及其相应接合子的质粒提取采用碱裂解法[ 4](Qiagen公司),提取物经0.8%琼脂糖电泳, 电压80 V,以大肠埃希菌 V517作为参照。经电泳分离的质粒转至硝酸纤维素尼龙膜(Amersham公司),以α-32P标记的KPC和DHA特异性探针进行DNA杂交试验[ 5] 。
3. β-内酰胺酶基因扩增和测序
采用PCR扩增碳青霉烯酶基因, 包括 bla KPC、 bla IMP、 bla VIM、 bla SME和 bla OXA-23等5种常见基因, 以及其他常见β-内酰胺酶基因, 包括 bla TEM、 bla SHV、 bla CTX和 bla D HA。煮沸法提取临床产气肠杆菌分离株及其相应接合子DNA,引物及扩增条件参考文献[6-10]。 扩增产物送TaKaRa公司测序, 测序结果在GenBank网上比对分析。
4. β-内酰胺酶等电聚焦电泳(isoelectric focusing electrophoresis, IEF) 分析
超声波破碎法提取临床分离株及其接合子的β-内酰胺酶。等电点(isoelectric point, pI)测定按PhastSystem电泳仪说明书操作, 电泳后用0.5 mmol/L头孢硝噻吩染色。用已知 pI值TEM-1(pI 5.4)、KPC-2(pI 6.7)、SHV-18(pI 7.6) 和 ACT-1(pI 9.0)作为pI对照。用CureveExpert 1.3 软件绘制pI标准曲线并判断β-内酰胺酶pI结果。
5. 药物敏感性试验
VITEK-32 GN-448卡检测为亚胺培南和美罗培南耐药的产气肠杆菌, 用琼脂扩散法检测乃为重复亚胺培南和美罗培南耐药。抗菌药物对临床分离株及其相应接合子的最低抑菌浓度(minimal inhibitive concentration, MIC)采用琼脂稀释法检测, 具体参照2009年美国临床实验室标准化协会(Clinical and Laboratory Standards Institute,CLSI)推荐的方法执行。
6. 外膜蛋白十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis ,SDS-PAGE)
以临床产气肠杆菌野生株作为对照, 以冰浴超声破碎法提取细菌外膜蛋白。简要步骤如下:收集40 mL 过夜增菌的水解酪蛋白胨肉汤, 以2 350× g 离心10 min 收集菌体, 50 mmol/L 磷酸盐缓冲液(phosphate buffered saline,PBS)洗涤1次, 10 mmol/L pH值7.0 Tris-HCl冰浴超声破碎,2 950× g 4 ℃离心10 min去除未破碎菌体,上清以26 800× g 4 ℃离心30 min留沉淀, 加入含2% SDS的pH值 7.4的PBS 5 mL, 室温静置30 min后以23 500× g 4 ℃离心40 min留沉淀, 然后加入0.3 mL 10 mmol/L pH值 7.0的PBS悬浮沉淀,-70 ℃备用。提取的外膜蛋白与上样缓冲液按比例混合, 煮沸10 min, Bio-Rad垂直电泳系统进行SDS-PAGE,电泳凝胶为5%浓缩胶和15%分离胶, 80 V恒压电泳2.5 h。电泳后考马斯亮蓝染色,采用Labimage凝胶分析软件计算临床分离菌株和对照株外膜蛋白相对分子质量。
接合试验结果显示,成功将碳青霉烯类药物耐药产气肠杆菌的耐药性质粒传递给受体菌大肠埃希菌600。QIAGEN质粒提取试剂盒抽提临床分离菌和接合菌的质粒, 以大肠埃希菌V517提取的质粒作为DNA标准参照进行琼脂糖电泳, 用Labimage软件计算质粒大小, 结果显示临床分离菌株和接合菌中均携带1个56 kb的质粒,见图1:
注:1为临床分离的产气肠杆菌的质粒; 2为接合菌的质粒; 3为大肠埃希菌V517 的质粒
分子杂交试验和特异性PCR扩增结果证实该质粒同时携带 KPC-2和 DHA-1 β-内酰胺酶基因,见图2、图3:
注:C24为接合菌;24为临床分离株
注:24为临床分离株;C24为接合菌
特异性PCR扩增产物送上海英骏公司经ABI-3730测序,DNA序列与GenBank数据库在网上比对分析显示,临床分离株携带 KPC-2基因、 DHA-1基因和 TEM-1基因,而接合菌携带 KPC-2基因和 DHA-1基因。
临床菌株β-内酰胺酶IEF结果显示有3条β-内酰胺酶条带,pI分别为5.4、6.7和7.8, 而相应接合菌显示有2个条带, pI分别为6.7和7.8。经特异性PCR和序列分析显示相应条带分别为TEM-1(pI 5.4)、KPC-2(pI 6.7)、DHA-1 (pI 7.8),见图4:
注:1为β-内酰胺酶条带; 2为临床菌株β-内酰胺酶条带;3、4为酶标准条带
临床分离株及其接合菌对亚胺培南、美罗培南、头孢噻肟、头孢他啶、头孢曲松、哌拉西林-他唑巴坦和阿米卡星均耐药,仅对左氧氟沙星敏感。接合菌对绝大部分所测试的抗菌药物MIC与供体菌相比均有所下降。碳青霉烯类抗菌药物在加入克拉维酸后MIC仅有轻度下降,见表1:
| 表1 临床分离株及相应接合菌药物敏感性试验结果 |
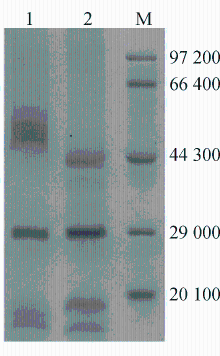
细菌外膜蛋白经SDS-PAGE分析后结果见图5:
注:1为临床分离株外膜蛋白条带; 2为对照株外膜蛋白条带;M为蛋白相对分子质量标准
临床野生菌可见2种外膜蛋白,分别为4 100条带和29 000条带, 亚胺培南耐药的产气肠杆菌为47 000条带(LamB)和29 000条带,与临床野生株对比可见有相对分子质量约为41 000的外膜蛋白缺失,而为41 000的外膜蛋白对应于大肠埃希菌的OmpC外膜蛋白,该膜蛋白与抗菌药物的内渗透有关。
产气肠杆菌是引起肠道外感染的重要病原菌,与许多医院感染的爆发流行有关,可引起肺炎、败血症和术后感染等[ 11]。碳青霉烯类抗菌药物对革兰阴性杆菌具有抗菌谱广、 抗菌活性强等特点, 是治疗医院感染常用药物之一, 尤其用于治疗产超广谱β-内酰胺酶和头孢菌素酶的肠杆菌科细菌所致的严重感染。随着碳青霉烯类药物在临床的广泛应用, 临床出现了耐药菌株。本研究中发现的一株泛耐型产气肠杆菌其表型试验显示对所测试的β-内酰胺类及氨基糖苷类药物广泛耐药,仅保持对喹诺酮类药物敏感。
肠杆菌属菌株耐碳青霉烯类抗菌药物的主要机制是:(1)产金属酶、OXA酶、KPC酶等水解碳青霉烯类药物的β-内酰胺酶[ 12]; (2)产头孢菌素酶合并外膜孔蛋白的缺失等。经过PCR扩增和序列分析显示泛耐株携带 KPC-2基因,IEF显示pI为6.7, 同时该菌株还表达pI约为5.4和7.8的β-内酰胺酶, PCR分析证实他们分别为TEM-1和DHA-1。质粒接合试验和分子杂交试验等结果显示, KPC-2和 DHA-1基因定位于一个可转移的大小约为56 kb的质粒上, 而TEM-1编码的基因不定位于该质粒上。
外膜蛋白是药物进入细菌与相应靶位点结合的特有通道,外膜蛋白缺失或结构、数量发生改变可影响药物进入菌体。本研究中泛耐型产气肠杆菌的外膜蛋白图谱与对照株相比,缺失了相对分子质量约为41 000条带,该膜蛋白相对应于大肠埃希菌的OmpC,是与抗菌药物内流有关的重要膜孔蛋白,包括碳青霉烯类、氨基糖苷类、氟喹诺酮类和单环酰胺类等多种药物均是通过OmpC和OmpF进入细菌体内发挥抗菌作用[ 13, 14]。接合子和泛耐株的药物敏感性试验结果比较,碳青霉烯类药物和氨基糖苷类药物的MIC均有所下降,该机制可能与外膜蛋白缺失有关,也不排除质粒转入受体菌后在接合菌中表达量下降。另外接合菌对氨基糖苷类药物也耐药,推测该基因可能和 KPC-2、 DHA-1基因定位于同一质粒上,具体机制有待进一步深入探讨。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|