研究临床分离的一株肺炎克雷伯菌(K30)对碳青霉烯类抗菌药物耐药的机制。
方法采用琼脂稀释法测定肺炎克雷伯菌K30对13种抗菌药物的最低抑菌浓度(MIC);用改良Hodge试验检测碳青霉烯酶;聚合酶链反应(PCR)检测A类碳青霉烯酶(
药物敏感性试验显示,肺炎克雷伯菌K30对包括碳青霉烯类抗菌药物在内的11种抗菌药物均耐药,仅对头孢西丁钠中介,对阿米卡星敏感。肺炎克雷伯菌K30的改良Hodge试验为阳性。PCR扩增A类碳青霉烯酶基因
临床分离的一株对碳青霉烯类抗菌药物耐药的肺炎克雷伯菌主要耐药机制与产A类碳青霉烯酶
To investigate the resistance mechanism of an isolate of
Minimum inhibition concentrations (MIC) of
The antimicrobial susceptibility test showed that
The main resistance mechanism of the isolate of
肺炎克雷伯菌( Klebsiella pneumoniae)广泛存在于自然界中,是肠道正常菌种之一。作为条件致病菌,其可引起皮肤、软组织、呼吸道、泌尿道和其他器官的感染。碳青霉烯类抗菌药物是治疗该类细菌感染的主要抗菌药物之一。近年来,随着碳青霉烯类抗菌药物的大量使用,临床开始出现耐碳青霉烯类抗菌药物的肺炎克雷伯菌。我们对四川省人民医院分离出的一株对3种碳青霉烯类抗菌药物(厄他培南、亚胺培南、美罗培南)均耐药的肺炎克雷伯菌进行了耐药机制分析。
1. 菌株来源
研究菌株[肺炎克雷伯菌(K30)]分离自四川省人民医院老年感染科的一位86岁女性患者的痰液,该菌株采用法国生物梅里埃公司的全自动微生物分析仪VITEK-2鉴定。大肠埃希菌(ATCC 25922)、肺炎克雷伯菌(ATCC 700603)均购自温州康泰生物技术公司。KPC-2型碳青霉烯酶阳性质控菌1014和接合试验受体菌大肠埃希菌600(Ec600)由浙江大学医学院附属第二医院张嵘教授惠赠。
2. 仪器与试剂
全自动微生物分析仪VITEK-2购自法国生物梅里埃公司;细菌多点接种仪购自日本Sakuma公司;离心机Microfuge 18 Centrifuge购自美国贝克曼库尔特公司;聚合酶链反应(polymerase chain reaction,PCR)扩增仪、电泳仪和凝胶成像仪购自美国Bio-Rad公司;ABI 7500定量PCR仪购自美国ABI公司;PrimeScriptx0dbc0;x0ddbf; RT reagent Kit With gDNA Eraser试剂盒购自大连宝生物工程有限公司;TRIzon RNA提取试剂、SYBRGreen I染料、2x000d7;Taq PCR MasterMix购自北京康为世纪生物科技有限公司;麦康凯琼脂平板购自郑州安图绿科生物公司;GoldViewTM核酸染料购自北京赛百盛基因技术有限公司;100 bp DNA Ladder、DNA Marker x02160;、DNA Marker x02161;购自北京TianGen公司;引物由上海英骏公司合成。
3. 抗菌药物
多黏菌素B购自美国Amresco公司;美罗培南购自美国Sigma公司;厄他培南、亚胺培南购自杭州默沙东公司;头孢西丁钠购自广州白云山天心公司;头孢他啶购自英国GlaxoSmithKline公司;头孢曲松钠购自上海罗氏公司;头孢吡肟购自中美上海施贵宝公司;头孢哌酮-舒巴坦购自辉瑞制药公司;氨曲南、阿米卡星均购自四川制药制剂公司;环丙沙星购自广州南新公司;左氧氟沙星购自新昌制药厂。
1.药物敏感性试验
采用琼脂稀释法检测肺炎克雷伯菌K30和质控菌株大肠埃希菌(ATCC 25922)对13种抗菌药物的最低抑菌浓度(minimal inhibitory concentration, MIC)。菌株体外药物敏感性测定结果参照美国临床实验室标准化协会(Clinical and Laboratory Standards Institute, CLSI) M100-S22[ 1]进行解释。头孢哌酮-舒巴坦和多黏菌素B的结果分别参照头孢哌酮和不动杆菌属的解释标准进行解释。
2.改良Hodge试验筛查碳青霉烯酶
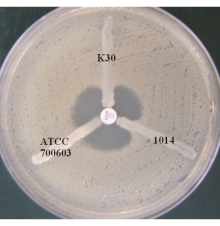
参照文献[2]进行改良Hodge试验操作,产KPC-2的肺炎克雷伯菌株1014为阳性对照,肺炎克雷伯菌(ATCC 700603)为阴性对照。美罗培南抑菌圈内出现待检菌矢状生长者为试验阳性,表明该菌产碳青霉烯酶。
3.PCR检测耐药基因和x02160;类整合子
采用煮沸法制备细菌DNA模板,采用PCR检测A类碳青霉烯酶、B类碳青霉烯酶(金属酶)、超广谱x003b2;-内酰胺酶(extended spectrum beta-lactamases, ESBLs)、头孢菌素酶(ampicillin carbapenemase, AmpC)和x02160;类整合子基因。14种基因以及x02160;类整合子的引物序列、退火温度和目的产物长度见表1:
| 表1 PCR引物序列及目的产物长度 |
KPC、 NDM、 IMP、 VIM、 SIM、 CTX、 TEM、 SHV和x02160;类整合子的PCR反应体系(20 x003bc;L):10 x003bc;L 2x000d7;Taq PCR MasterMix,正反向引物各1 x003bc;L(10 x003bc;mol/L),2 x003bc;L DNA模板,6 x003bc;L dH2O;AmpC基因( FOX、 EBC、 ACC、 DHA、 CIT、 MOX)采用多重PCR的方法,其反应体系(50 x003bc;L):25 x003bc;L 2x000d7;Taq PCR MasterMix, DHA、 CIT、 MOX的正反向引物各1.5 x003bc;L(20 x003bc;mol/L), EBC、 ACC的正反向引物各1.25 x003bc;L(20 x003bc;mol/L), FOX的正反向引物各1 x003bc;L(20 x003bc;mol/L),2 x003bc;L DNA模板,7 x003bc;L dH2O。PCR反应条件:94 ℃预变性3 min,94 ℃变性1 min,退火1 min(根据不同引物确定各自的退火温度),72 ℃延伸1 min,30个循环周期,72 ℃延伸10 min。其中KPC阳性质控菌为产KPC-2的肺炎克雷伯菌1014。
PCR反应产物经琼脂糖凝胶电泳后利用凝胶成像系统观察并成像。将所有耐药基因扩增阳性的PCR产物送上海英骏公司测序,测序较理想的结果与GenBank数据库的序列进行比对分析。
4. 实时荧光定量PCR检测膜孔蛋白基因的表达
用TRIzol提取肺炎克雷伯菌K30和ATCC 700603的RNA,然后逆转录为cDNA。以cDNA为模板,采用实时荧光定量逆转录PCR结合分析软件获得肺炎克雷伯菌膜孔蛋白基因 ompK35、 ompK36和内参基因 rpoB的循环阈值(Ct),所需的引物序列和反应条件参考文献[10]。菌株的每个膜孔蛋白检测均重复3次,最后得Ct的平均值。利用Ct值计算 ompK35和 ompK36的基因表达量,其计算公式[ 11]:2-△△Ct。
5.质粒接合试验
质粒接合试验参照文献[12],其简要步骤:将受体菌Ec600(耐利福平)和肺炎克雷伯菌K30(耐美罗培南)悬液混合,首先涂布在不含选择抗菌药物的营养琼脂平板上。经培养后收集细菌,将细菌接种在含有抗菌药物(100 x003bc;g/mL利福平+0.25 x003bc;g/mL美罗培南)的筛选平板上,对生长出的菌落做生化鉴定,筛选结合子。如筛选出结合子则检测结合子的体外药物敏感性和耐药基因。
肺炎克雷伯菌K30对11种抗菌药物均耐药,仅对头孢西丁钠中介,对阿米卡星敏感。其中对3种碳青霉烯类抗菌药物均耐药,厄他培南、美罗培南和亚胺培南MIC分别为4、32和4 x003bc;g/mL。质控大肠埃希菌(ATCC 25922)的药物敏感性结果较理想,具体药物敏感性谱见表2:
| 表2 肺炎克雷伯菌K30的体外药物敏感性试验结果 |
肺炎克雷伯菌K30和阳性对照1014的改良Hodge试验均为阳性,提示肺炎克雷伯菌K30可能产碳青霉烯酶,阴性对照肺炎克雷伯菌(ATCC 700603)结果为阴性,见图1:
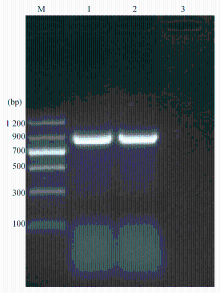
肺炎克雷伯菌K30经PCR扩增A类碳青霉烯酶基因 KPC和2种ESBLs基因 CTX、 SHV阳性,其PCR产物经测序后同GenBank数据库比对证实分别为 KPC-2、 CTX-M3和 SHV-38,见图2和图3:
注:M为DNA Marker x02161;;1为 KPC-2阳性质控菌1014;2为肺炎克雷伯菌K30;3为阴性对照
其余耐药基因和x02160;类整合子扩增均为阴性。
与肺炎克雷伯菌(ATCC 700603)相比,肺炎克雷伯菌K30的膜孔蛋白 ompK35和 ompK36的表达均未见下降,见表3:
| 表3 肺炎克雷伯菌K30的 ompK35和 ompK36定量结果(3株) |
质粒接合试验未成功获取结合子。
肺炎克雷伯菌是最常见的肠杆菌科细菌之一,该菌是社区获得性感染和医院感染的重要病原菌。碳青霉烯类抗菌药物是以亚胺培南、美罗培南和厄他培南为代表的一组具有特定分子结构的x003b2;-内酰胺类抗菌药物,杀菌活性优于头孢菌素类抗菌药物,是治疗产ESBLs和AmpC菌株的强效抗菌药物。但是近年来对该类抗菌药物的大量和不合理使用,导致耐碳青霉烯类抗菌药物的肺炎克雷伯菌不断增加,引起了临床医务工作者的高度重视。肺炎克雷伯菌对碳青霉烯类抗菌药物耐药的主要机制包括:膜孔蛋白(ompK35、ompK36)的缺失或表达降低所引起的膜通透性下降;高产AmpC合并膜孔蛋白缺失引起膜通透性下降;产生水解碳青霉烯类抗菌药物的碳青霉烯酶(主要是A类和B类)。
本研究的肺炎克雷伯菌K30分离自一位86岁女性患者的痰液。该菌呈现一个多重耐药性,不仅对3种碳青霉烯类抗菌药物均耐药,且对多黏菌素B的MIC>32 x003bc;g/mL。肺炎克雷伯菌K30对头孢菌素类和氨基糖苷类抗菌药物(除阿米卡星)不敏感。本研究通过改良Hodge试验检测肺炎克雷伯菌K30为阳性,提示该菌可能产碳青霉烯酶;经过PCR扩增、测序后证实该菌产A类碳青霉烯酶KPC-2,并且携带有ESBLs基因 CTX-M3和 SHV-38;膜孔蛋白基因 ompK35、 ompK36的mRNA表达没有降低。提示该菌对碳青霉烯类抗菌药物耐药可能不是由膜孔蛋白表达降低所致,主要机制是产A类碳青霉烯酶(KPC-2)合并产ESBLs。质粒接合试验未成功获取结合子,说明肺炎克雷伯菌K30的 KPC-2基因可能不由质粒介导。2010年Landman等[ 13]报道在纽约地区的大肠埃希菌中一共分离出30株携带KPC,另外在该地区很多医院分离出携带KPC的细菌为肺炎克雷伯菌。2010年Sheng等[ 14]在一位食管癌患者的胸腔引流液中分离出一株产KPC-2的奇异变形杆菌,经对基因上下游比对分析得出该KPC-2与2007年在中国报道的肺炎克雷伯菌中KPC-2相同。2012年Hu等[ 15]报道在上海复旦大学附属华山医院的77株肠杆菌科细菌中检测出KPC型碳青霉烯酶,且产KPC的弗劳地枸橼酸杆菌和肺炎克雷伯菌有同源性。
通过本研究和结合文献发现产KPC型碳青霉烯酶的肠杆菌已呈现一种流行趋势,应引起我们的高度重视。为提高临床的治疗效果应减少经验性用药,根据药物敏感性试验结果规范地使用抗菌药物。医院要加强耐碳青霉烯类抗菌药物菌株的监测和控制,以尽量减缓耐药菌株的产生和播散。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|