作者简介:王艳,女,1981年生,硕士,医师,主要从事临床微生物学及免疫学检验工作。
通讯作者:张力平,联系电话:010-83911742。
探讨链球菌蛋白诱导人脑多形性胶质母细胞瘤BT325细胞周期阻滞及凋亡的相关作用机制。
方法体外培养人脑多形性胶质母细胞瘤BT325细胞,噻唑蓝(MTT)法检测细胞增殖活性,倒置显微镜下观察细胞形态变化,原位染色后荧光显微镜下观察凋亡细胞,流式细胞术检测细胞周期、细胞凋亡率及线粒体膜电位(MMP),蛋白质印迹法(Western blot)检测细胞凋亡相关蛋白的表达。
结果链球菌蛋白(10~100 mg/L)可显著抑制细胞增殖,使细胞周期阻滞于G2/M期,呈时间和剂量依赖性;链球菌蛋白作用细胞24 h后,MMP显著下降(
链球菌蛋白可显著抑制人脑多形性胶质母细胞瘤BT325细胞增殖,影响细胞周期分布,通过线粒体途径诱导细胞发生凋亡,由此发挥其抗肿瘤活性作用。
To investigate the mechanisms of streptococcal protein inducing cycle arrest and apoptosis in human cerebral glioblastoma BT325 cell.
MethodsHuman cerebral glioblastoma BT325 cells were cultured in vitro, and methlcyclopentadienyl manganese tricarbonyl (MTT) assay was used to determine the proliferation activity of BT325 cells. The morphological changes of BT325 cells were observed by the phase-contrast microscopy. The apoptotic cells were observed after fluorescence staining. Flow cytometry was used to determine the cell cycle, the rate of cell apoptosis and the change of mitochondrial membrane potential (MMP). The expression of apoptosis-related proteins was determined by Western blot.
ResultsStreptococcal protein (10-100 mg/L) inhibited the proliferation of BT325 cells significantly and induced G2/M phase arrest in time- and dose-dependent manners. MMP declined(
Streptococcal protein may exert its anticancer activity through inhibiting the proliferation of human cerebral glioblastoma BT325 cells, effecting the distribution of cell cycle and inducing cell apoptosis by mitochondrial-dependent pathway.
链球菌具有抗肿瘤作用,由低毒链球菌Su株经青霉素处理并真空冷冻干燥后制成的链球菌制剂(OK-432)在日本已广泛应用于肿瘤治疗。临床观察表明,OK-432对多种进展期肿瘤,如胃癌、肺癌、宫颈癌、口腔鳞状细胞癌和头颈部肿瘤等均有显著抗肿瘤作用[ 1, 2]。OK-432是一种链球菌全菌体制剂,其发挥抗肿瘤效应的成分尚未明确,我们前期研究证实,链球菌蛋白对人肝癌Bel-7402细胞具有明显的增殖抑制作用[ 3]。但是,有关链球菌对人脑胶质母细胞瘤的直接作用及其相关机制尚未见报道。因此,本研究通过观察链球菌蛋白对体外培养的人脑多形性胶质母细胞瘤BT325细胞的增殖、细胞周期分布及细胞凋亡的影响,进一步阐明链球菌抗肿瘤作用的分子机制,为以链球菌为原料进行抗肿瘤生物制剂的开发和利用提供理论和实验依据。
人脑多形性胶质母细胞瘤细胞株(BT325,北京天坛医院神经外科研究所),胰酶大豆肉汤培养基(TSBY,Difico公司),DMEM高糖培养基(Hyclone公司),磷酸盐缓冲液(phosphate buffered saline, PBS,Gibco公司),噻唑蓝(methylcyclopentadienyl manganese tricarbonyl, MTT,Sigma公司),胎牛血清(fetal bovine serum, FBS,杭州四季青公司),DNA荧光探针碘化丙啶(propidium iodide, PI,Fluka公司),钙依赖性磷脂结合蛋白Ⅴ和PI(Annexin-V/PI)细胞凋亡试剂盒(北京宝赛生物技术有限公司),线粒体荧光探针罗丹明(Rho123,Merck公司),内参β-actin、B淋巴细胞瘤-2(β-cell lymphoma-2,Bcl-2)、半胱氨酸天冬氨酸蛋白酶3前体(precursor of cysteinyl aspartate specific proteinase 3, Procaspase-3)、细胞色素C(mitochondrial cytochrome C, Cyt C)单克隆抗体(Santa Cruz公司),P53单克隆抗体(Calbiochem公司),辣根过氧化物酶(horse radish peroxidase, HRP)标记的羊抗鼠、羊抗兔IgG(武汉博士德生物技术有限公司),电化学发光(electrochemiluminescence, ECL)试剂(Millipore公司)。
1. 细菌蛋白的提取
A群溶血性链球菌32080株(中国医学细菌保藏中心),本室前期体外实验证实此菌株同制备OK-432的Su株类似,具有较强的抗肿瘤功能。链球菌在TSBY培养基中37 ℃培养,取对数生长末期细菌,参照Winters的方法[ 4]提取链球菌蛋白。
2. 细胞增殖抑制实验及细胞形态学观察
细胞用含10% PBS的DMEM高糖培养基常规培养传代。将处于对数生长期的BT325细胞(1×105/L)接种于96孔板中,每孔100 μL。37 ℃、5% CO2条件下培养4 h后, 实验组分别加入含有链球菌蛋白(终浓度为10、50和100 mg/L)的培养基100 μL,同时设只含培养基(100 μL /孔)的对照组,分别继续作用细胞24、48和72 h,终止前4 h每孔加入浓度为5 g/L的MTT 20 μL。终止时每孔加入150 μL 二甲基亚砜(dimethyl sulfoxide, DMSO),震荡混匀10 min,酶标仪上测定570 nm吸光度( A)值。同时,BT325细胞以1×105/孔接种于6孔板中,50 mg/L的链球菌蛋白作用细胞24、48和72 h后,倒置显微镜下直接观察细胞形态变化。
3.DNA倍体分析检测细胞周期
链球菌蛋白(10~100 mg/L)作用BT325细胞24、48和72 h后,每组收集1×106个细胞,PBS洗涤2次,70%的冷乙醇4 ℃固定过夜。用PBS洗涤2次后,核糖核酸(RNase)酶(终浓度100 mg/L)37 ℃孵育30 min,加入PI(终浓度为100 mg/L),4 ℃避光反应30 min后,采用流式细胞仪分析细胞周期各时相细胞比率的变化。
4. Rho123染色法检测线粒体膜电位(mitochondrial membrane potential,MMP)
链球菌蛋白(10~100 mg/L)作用于BT325细胞24 h后,每组收集1×106个细胞,PBS洗涤2次,用新鲜培养基1 mL悬浮细胞,加入终浓度为5 mg/L的Rho123,37 ℃避光孵育30 min。经PBS洗涤细胞2次后,再用1 mL PBS重悬细胞,在流式细胞仪上检测MMP。
5. 原位染色法观察凋亡细胞
BT325细胞以5×104/孔接种于24孔板中,链球菌蛋白(10~100 mg/L)作用细胞24 h后,PBS洗涤细胞2次,加入Annexin-V-异硫氰酸荧光素(fluorescein isothiocyanate, FITC)/PI双染色,避光作用10 min,于倒置荧光显微镜下观察凋亡细胞。
6. Annexin-V/PI检测细胞凋亡率
链球菌蛋白(10~100 mg/L)作用BT325细胞48 h后,每组收集1×106个细胞,PBS洗涤1次后,参照Annexin-V/PI细胞凋亡检测试剂盒说明处理细胞,采用流式细胞仪检测细胞的凋亡率。
7. 蛋白质印迹法(Western blot)检测细胞凋亡相关蛋白的表达
链球菌蛋白(50 mg/L)作用于BT325细胞24、48和72 h后,每组收集1×107个细胞, PBS 洗涤1次后,参照文献[5]方法提取细胞总蛋白。蛋白样本煮沸变性,经电泳、转膜、封闭后,分别加入P53抗体(1∶200)、Bcl-2抗体 (1∶500)、Procaspase-3 抗体(1∶200)、Cyt C抗体(1∶1 000) 和 β-actin 抗体(1∶1 000) 4 ℃结合过夜,HRP标记的IgG ( 1∶5 000) 室温孵育1 h,洗膜后与底物ECL试剂反应,X 线片曝光显示结果。
采用SPSS 11.5软件进行统计分析,数据以 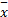
链球菌蛋白(10~100 mg/L)能明显抑制BT325细胞增殖( P<0.05或 P<0.01),其中以100 mg/L链球菌蛋白作用72 h效果最为显著,见表1:
表1 链球菌蛋白对BT325细胞的增殖抑制作用  |
倒置显微镜下显示,正常对照组细胞生长状态良好,折光性强,呈梭形贴壁生长。50 mg/L链球菌蛋白作用24 h后细胞折光率下降,胞内可见颗粒样物质;作用48 h后细胞形态变得不太规则;作用72 h后大多数细胞圆缩离壁,且细胞生长密度降低,见图1:
注:(a)0 h;(b)24 h;(c)48 h;(d)72 h
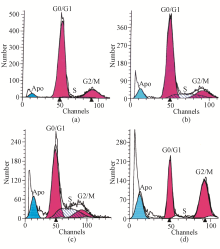
对数生长期BT325细胞大多数处于G0/G1期和G2/M期,S期最少。BT325细胞经链球菌蛋白(10~100 mg/L)作用24~48 h后细胞周期发生明显改变,表现为S期细胞百分率显著增加( P<0.01),G2/M期显著降低( P<0.05或 P<0.01),有剂量依赖关系。随着作用时间的延长,凋亡细胞增多,72 h后细胞周期最终阻滞于G2/M期( P<0.01),见图2、表2:
注:(a)0 h;(b)24 h;(c)48 h;(d)72 h;Apo为凋亡
表2 链球菌蛋白对BT325细胞周期的影响 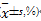 |
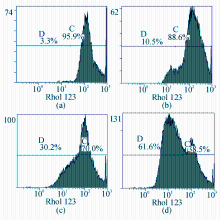
链球菌蛋白(10~100 mg/L)作用BT325细胞24 h后,随蛋白浓度升高,弱荧光部分(D区)细胞百分率逐渐增高,强荧光部分(C区)比率减少,阳性峰左移,与对照组相比,中高浓度组(50~100 mg/L)细胞MMP下降显著( P<0.01),见表3、图3:
表3 链球菌蛋白作用24 h后对BT325细胞MMP的影响 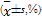 |
注:链球菌蛋白,(a)0 mg/L;(b) 10 mg/L;(c) 50 mg/L;(d) 100 mg/L
链球菌蛋白(10~100 mg/L)作用BT325细胞24 h,经Annexin-V-FITC/PI双染后,早期凋亡细胞的胞膜结合Annexin-V显示绿色,晚期凋亡细胞的胞核被PI红染,胞膜被Annexin-V绿染,坏死细胞则全染成红色。随细菌蛋白浓度的增加,凋亡细胞逐渐增多,见图4:
注:链球菌蛋白,(a)0 mg/L;(b) 10 mg/L;(c) 50 mg/L;(d) 100 mg/L
采用流式细胞仪检测链球菌蛋白作用细胞48 h的细胞凋亡百分率,结果显示早、晚期细胞凋亡百分率随蛋白浓度的升高而明显增加( P<0.01),见图5、表 4:
注:链球菌蛋白,(a)0 mg/L;(b) 10 mg/L;(c) 50 mg/L;(d) 100 mg/L
表4 链球菌蛋白作用48 h后对BT325细胞凋亡率的影响 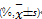 |
Western blot结果显示,50 mg/L的链球菌蛋白作用于BT325细胞,随作用时间的延长,抑癌基因 p53表达明显上调,凋亡抑制蛋白Bcl-2表达逐渐降低,且在72 h时表达缺失, 细胞线粒体释放到胞质中的Cyt C表达增多, Procaspase-3表达下调激活细胞凋亡过程中半胱氨酸天冬氨酸蛋白酶(cysteinyl aspartate specific proteinase, Caspase)家族的级联反应,从而导致细胞凋亡的发生,见图6:
细胞周期调控是机体维持细胞有序增殖及稳定基因组的关键,它的失控是肿瘤发生的重要原因之一,抗肿瘤药物对肿瘤细胞的增殖抑制作用常通过对细胞分裂产生周期阻滞而实现,且不同影响因素有不同的周期特异性[ 6]。本研究结果显示,较低作用浓度(10 mg/L)的链球菌蛋白就可以抑制BT325细胞增殖 ,且在 10~100 mg/L浓度范围内对细胞株的增殖抑制作用呈浓度和时间依赖性。同时,肿瘤细胞形态学亦出现相应改变,推断其机制与链球菌蛋白可能直接损伤细胞DNA有关。本研究显示,随着蛋白作用时间的延长,凋亡细胞增加,72 h后S期细胞明显减少,细胞周期最终阻滞于G2/M期,这与Lin等[ 7, 8]的研究结果类似。
干扰细胞周期过程可引起细胞凋亡,而细胞凋亡与肿瘤的发生、发展及其治疗都有密切关系,因此探讨各种诱导肿瘤细胞凋亡的途径成为研究肿瘤治疗的一个新方向[ 9]。目前认为,细胞凋亡过程受到来自细胞内外诸多信号的调控,线粒体通路是最普遍的凋亡信号通路之一[ 10, 11]。检测MMP中,以线粒体跨膜电位的高低作为鉴定细胞凋亡指标之一,结果表明链球菌蛋白作用细胞24 h后,10 mg/L细菌蛋白作用细胞的弱荧光细胞数开始增多,50和100 mg/L细菌蛋白处理细胞的弱荧光细胞比率分别达到(28.57±1.82)%和(46.00±2.54)%,提示线粒体膜的通透性转换孔复合体开放,使内膜离子通道改变,MMP下降或丧失,线粒体功能受损,导致线粒体内凋亡相关蛋白的释放来诱导细胞进入凋亡程序。除直接促进下游促凋亡因子的转录来诱导细胞凋亡外, p53抑癌基因的另一主要促凋亡途径就是内源性线粒体途径。活化的P53向线粒体快速转位,并与位于线粒体膜上的Bcl家族成员相互作用,改变线粒体外膜通透性,使线粒体内促凋亡蛋白Cyt C、Smac(Diablo)和凋亡诱导因子(AIF)、HtrA2(Omi)和EndoG等释放到胞质,激活Caspase等效应分子,从而诱导细胞凋亡[ 11, 12]。Caspase-3是细胞凋亡中起最终执行作用的重要剪切酶,它以低活性酶原Procaspase-3的形式合成出来。只有当Procaspase-3被活化后才能发挥功能,病变细胞中该转化机制有可能会被破坏,所以在大部分癌细胞中发现Procaspase-3水平高于正常细胞[ 13]。本研究表明,随链球菌蛋白作用时间的延长,P53蛋白表达水平逐渐增强,维持细胞线粒体膜稳定性的抗凋亡蛋白Bcl-2表达明显下调,细胞线粒体内促凋亡蛋白Cyt C表达有明显增加趋势,通过下调Procaspase-3的表达激活细胞凋亡的下游事件,最终使BT325细胞发生凋亡。
综上所述,链球菌蛋白对人脑多形性胶质母细胞瘤BT325细胞具有明显的增殖抑制作用,将细胞周期阻滞于G2/M期,降低MMP,影响P53、Procaspase-3、Bcl-2和Cyt C等重要凋亡相关蛋白的表达,初步揭示了线粒体途径可能是链球菌蛋白诱导BT325细胞发生凋亡的作用机制之一,为用链球菌治疗人脑胶质母细胞瘤提供了新的重要实验依据,具有潜在应用前景。但是,链球菌蛋白对细胞周期蛋白、细胞线粒体功能异常的相关作用位点及其他促凋亡途径的作用等还有待进一步深入研究。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|