作者简介:刘长营,男,1982年生,硕士,技师,主要从事分子免疫和细胞免疫研究。
研究内皮细胞脱落的内皮微粒(EMP)对体外培养的T淋巴细胞活化增殖和产生细胞因子的影响,探讨EMP在免疫应答中的作用。
方法以人内皮细胞来源和SD大鼠内皮细胞来源的EMP干预BN大鼠淋巴细胞。采用流式细胞术检测T淋巴细胞(CD3+淋巴细胞)早期活化分子CD69的表达;采用酶联免疫吸附试验(ELISA)检测各组细胞培养液上清中相关细胞因子γ干扰素(IFN-γ)及白细胞介素2(IL-2)的表达水平。
结果与对照组[加入等体积磷酸盐缓冲液(PBS)]相比,EMP各浓度组T淋巴细胞早期活化分子CD69和培养液上清IFN-γ的表达水平显著增高(
EMP可刺激T淋巴细胞活化,诱导产生Th1型细胞因子,表明EMP可通过活化T淋巴细胞并产生一系列生物学效应,促进T细胞介导的细胞免疫应答。
To study the influence of vascular endothelial microparticles (EMP) on T lymphocyte activation in vitro and the cytokine production, and to study the roles of EMP on immune response.
MethodsLymphocytes from BN rats were interfered by EMP derived from human endothelial cells and SD rat's endothelial cells. The early activation CD69 expression of T lymphocytes (CD3+ lymphocytes) was measured by flow cytometry. Cytokines such as interferon-gamma (IFN-γ) and interleukin 2 (IL-2) were measured for expression by enzyme-linked immunosorbent assay (ELISA).
ResultsCompared with those of control group [adding same volune of phosphate buffer (PBS)], the expressions of CD69 and IFN-γ in culture supernatant of each EMP concentration group increased remarkably (
EMP can induce T lymphocyte activation and Th1 cytokine production. EMP may play an important role in immune response through activating T lymphocytes.
内皮微粒(endothelial microparticle,EMP)是当内皮细胞活化或凋亡时细胞的膜结构改变,磷脂酰丝氨酸(phosphatidylserine,PS)外翻,以“出泡”的方式从细胞膜上脱落的微颗粒物质。EMP带有内皮细胞膜表面蛋白和细胞浆成分,有促凝、促炎症和改变血管功能的作用。EMP作为内皮细胞受损伤的标志,正成为目前研究的热点[ 1, 2]。T淋巴细胞是负责机体特异性免疫应答的主要细胞,现有多项研究表明EMP可对免疫细胞产生重要影响。但关于EMP对T淋巴细胞功能影响方面的研究还未见报道。本研究采用人内皮细胞来源和SD大鼠内皮细胞来源的EMP刺激BN大鼠淋巴细胞,初步探讨EMP对T淋巴细胞活化及功能状态的影响。
DMEM高糖培养基及RPMI1640培养基干粉为美国Gibco公司产品。胎牛血清为民海生物公司产品。大鼠淋巴细胞分离液为美德太平洋生化公司产品。刀豆蛋白A(concanavalin A, ConA)、戊巴比妥钠、多聚甲醛、考马斯亮蓝等化学试剂为美国Sigma公司产品。钙依赖性磷脂结合蛋白Ⅴ(Annexin-Ⅴ)-异硫氰酸荧光素(fluorescein isothiocyanate,FITC)荧光染料、大鼠白细胞介素2(interleukin 2, IL-2)及γ干扰素(interferon-gamma, IFN-γ)、酶联免疫吸附试验(enzyme-linked immunosorbent, ELISA)试剂盒为北京四正柏生物科技有限公司产品。兔抗人第Ⅷ因子相关抗原多克隆抗体及生物素标记山羊抗兔IgG为北京中山生物技术公司产品。抗鼠CD69-FITC及抗鼠CD3-藻红蛋白(phycoerythrin,PE)荧光抗体为美国eBioscience公司产品。
1. 细胞培养
Eahy926细胞采用含10%胎牛血清的高糖DMEM培养基在37 ℃、5% CO2、饱和湿度培养,至Eahy926细胞生长成单层后备用。
大鼠微血管内皮细胞(pulmonary micro-vascular endothelial cells,PMVEC)的培养方法参照文献[3]并略做修改。细胞经第Ⅷ因子相关抗原免疫组织化学染色鉴定,确认培养的PMVEC可用于实验研究。
2. 诱导内皮细胞活化产生EMP
参照Angelot等[ 4]刺激人表皮微血管内皮细胞(human microvascular endothelial cell,HMEC)获取微粒的方法,以100 ng/mL的肿瘤坏死因子α(tumor necrosis factor-alpha, TNF-α)刺激Eahy926细胞或PMVEC诱导产生EMP。细胞经TNF-α刺激培养48 h后收集培养液上清,1 200× g离心5 min以去除脱落的细胞和细胞碎片;吸取上清液,4 ℃ 18 000× g离心60 min;沉淀于管底的EMP用培养液重悬,尽快用于后续实验。
3. EMP的鉴定及定量检测
采用Annexin-Ⅴ-FITC与微粒避光孵育,微粒因其表面的PS能与Annexin-Ⅴ-FITC结合而带有绿色荧光,通过激光共聚焦显微镜即可对微粒进行鉴定分析。为了精确地定量所分离的EMP,采用Bradford法检测微粒蛋白的含量,从而通过其蛋白含量反映样本中微粒量的多少,即以样本蛋白浓度计量微粒[ 5]。
4. 大鼠脾脏淋巴细胞的分离及分组培养
取8周龄(200±20)g体重健康BN大鼠,无菌取脾,200目细胞筛上剪切研磨组织,及时用磷酸盐缓冲液(phosphate buffered saline, PBS)冲洗使细胞充分透过滤网。大鼠淋巴细胞分离液分离脾细胞悬液中的单个核细胞,D-Hanks液洗2次(150× g,5 min);RPMI1640(15%胎牛血清、2 mmol/L L-谷氨酰胺、100 U/mL青霉素、100 U/mL链霉素)重悬,取少量细胞悬液以0.4%台盼兰染色检测细胞活力,细胞活力>98%,调整细胞浓度至1×106/mL,备用。将分离得的淋巴细胞按如下分组方案实施干预:A组,即正常对照组,加入等体积PBS;B组,加入10 μg/mL(终浓度,下同)EMP(Eahy926细胞来源);C组,加入20 μg/mL EMP(Eahy926细胞来源);D组,加入40 μg/mL EMP(Eahy926细胞来源);E组,加入终浓度为5 μg/mL的ConA;F组,加入终浓度为40 μg/mL的EMP(PMVEC来源)。
5. T淋巴细胞表面分子CD69的表达分析
将淋巴细胞悬液按1.5 mL/孔接种于24孔板,并按上述分组对淋巴细胞进行干预,每组设3个复孔。另设空白对照孔,与A组相同,用作流式检测空白对照分析。各组细胞在5% CO2、37 ℃培养箱培养10 h后,轻轻吹打板底使细胞悬起,转入离心管,340× g离心15 min收集细胞,PBS洗涤细胞2次。结合缓冲液100 μL重悬细胞,按抗体使用说明加入抗鼠CD3-PE 5 μL、抗鼠CD69-FITC 5 μL(空白对照不加抗体,以等体积PBS替代之),室温避光孵育30 min;洗涤2次后,500 μL PBS重悬细胞并转入流式反应管中,上机检测。
所有样本经FACS Calibur流式细胞仪和CELL Quest软件获取。取空白对照管,调节电压值并在前向散射(forward scattering coordinate,FSC)对侧向散射(side scattering coordinate,SSC)二维散点图中划出淋巴细胞区R1;在横坐标为CD3-PE、纵坐标为SSC的图中划出 CD3+细胞区R2(T细胞群);取荧光补偿调节管进行荧光补偿调节;然后对T淋巴细胞上的 CD69-FITC的荧光强度进行检测。每管细胞悬液样本检测10 000个细胞,获得的数据用CELL Quest软件进行分析。
6. 培养液上清细胞因子IFN-γ和IL-2水平检测
将淋巴细胞悬液按200 μL/孔接种于96孔板,并按上述分组对淋巴细胞进行干预,每组设3个复孔。各组细胞经培养48 h后,室温340× g离心15 min,每孔吸取上清120 μL,收集于Eppendorf管,-20 ℃保存备用。IFN-γ及IL-2水平的检测参照ELISA试剂盒说明进行操作。
采用SPSS 13.0软件统计分析,所有数据以 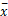
经过对培养方案积极改进,我们掌握了大鼠 PMVEC的原代培养技术并成功培养出纯度高、寿命长、增殖旺盛的大鼠PMVEC。原代培养8~10 d后可见培养瓶底细胞基本融合成片,呈现明显的上皮样细胞形态,见图1。免疫组织化学染色显示大鼠PMVEC第Ⅷ因子相关抗原阳性表达,细胞呈典型的胞浆棕黄色着色,见图1:
注:(a)为原代培养10 d后的大鼠肺PMVEC,可见细胞基本融合成片,外观呈鹅卵石样或铺路石样镶嵌状排列生长;(b)为第Ⅷ因子相关抗原免疫组织化学染色后照片
上述结果表明,原代培养的细胞生长状态及纯度符合本实验要求。
EMP经Annexin-Ⅴ-FITC染色,涂片后在激光共聚焦显微镜下观察,呈绿色点状颗粒,大小不均,散在分布,且阳性颗粒与普通光学显微镜下位置对应关系较好。我们采用Bradford法定量所分离的EMP,实验中以牛血清白蛋白为标准品绘制标准曲线,曲线方程为: Y=70 .989 X-2 .839 5, R2 =0.965 3。以蛋白量计,所测样本EMP浓度在0.5~1 μg/μL之间。
在FSC和SSC二维散点图中,划出淋巴细胞区R1,在横坐标为CD3-PE、纵坐标为SSC的图中,划出CD3+细胞区亦即T细胞群R2;然后对T淋巴细胞上的CD69-FITC的荧光强度进行检测,见图2:
注:(a)根据淋巴细胞的特性,FSC和SSC二维散点图中划定淋巴细胞区域(R1);(b)第2次设门划定CD3+阳性细胞区(R2)即T淋巴细胞区;(c)~(h)依次为A、B、C、D、E、F各组CD69+细胞比率
对应“材料和方法”中的分组,各组CD69+细胞表达率分别为A组(9.48±0.55)%;B组(20.82±1.10)%;C组(24.28±1.04)%;D组(42.48±2.10)%;E组(61.38±2.62)%;F组(34.53±1.95)%。结果显示,EMP各浓度组、ConA组、PMVEC来源EMP干预组CD3+细胞CD69分子的表达较对照组均明显增高( P<0.05),且ConA组CD3+细胞CD69分子表达显著高于其他各组( P<0.05) 。
EMP由活化或凋亡的血管内皮细胞产生并脱落于血液中。内皮细胞活化后可作为抗原递呈细胞(antigen presenting cell, APC)向受者T淋巴细胞递呈供者抗原,且对细胞因子具有高度反应性,并表达与淋巴细胞表面配体相互作用的多种分子。EMP携带了大量其来源细胞(内皮细胞)的丰富信息,这对了解疾病状态下内皮细胞的功能状态极为重要。有研究表明,EMP具有多种生物学活性,参与机体多种病理生理学过程。如EMP在促凝血反应、促炎症反应、调节血管张力及免疫调节等诸多方面发挥着重要作用[ 6]。
EMP与免疫细胞的关系是研究EMP生理病理学意义的重要切入点。最近的研究显示,EMP可诱导浆细胞样树突细胞(plasmacytoid dendritic cell, PDC)成熟并产生各种炎性细胞因子如IL-6和IL-8,并认为EMP可能是免疫调节性疗法的重要靶点[ 4]。Kolowos等[ 7]将单核巨噬细胞和树突状细胞来源的微粒同CD4+ T细胞共育,结果发现这2种微粒均可诱导CD4+ T细胞活化。另有研究发现,EMP能促使单核细胞分泌内皮细胞生长因子,从而促进单核细胞介导的内皮细胞活化增殖[ 8],而活化的内皮细胞可产生新的EMP。以上这些发现提示EMP可能也会对T淋巴细胞产生某种影响。
在Eahy926细胞及原代PMVEC来源的EMP与淋巴细胞共育10 h后,T淋巴细胞高表达CD69分子,同对照组相比具有显著差异。CD69是T淋巴细胞早期活化的标志。这表明EMP能诱导T淋巴细胞活化,而且其活化效率与EMP干预量有关,高浓度EMP干预组CD69表达水平明显高于低浓度EMP干预组。作为T细胞活化早期表达的蛋白,CD69可以引发一系列免疫反应[ 9, 10]。我们分析,EMP携带的丰富的表面分子可能为APC与T细胞间的相互作用创造了条件,EMP的重要免疫调节特性与此是密不可分的[ 11]。由于APC和T细胞间的分子转运不仅仅是APC至T细胞单向传递过程,还是一个交互过程,与此同时APC的功能也随之受到调节[ 12]。在实验的反应体系中EMP可通过单核细胞等APC处理加工并递呈其所携带的异己抗原肽供T淋巴细胞识别,在此过程中APC与T淋巴细胞相互诱导活化。
为探讨EMP对T淋巴细胞功能的影响,我们从EMP对CD4+ T淋巴细胞作用入手,探讨EMP 对CD4+T淋巴细胞分泌细胞因子的影响。实验检测分析了不同干预量EMP刺激对T细胞产生IFN-γ和IL-2的影响。将人内皮细胞(Eahy926细胞)和SD大鼠肺内皮细胞来源的EMP分别与BN大鼠淋巴细胞共育(含少量单核细胞)后,在培养液上清中检测到IFN-γ和IL-2水平表达明显高于对照组,这表明以上异种和同种细胞来源的EMP均能诱导产生Th1型细胞因子IFN-γ和IL-2。
体内IFN-γ主要来源于淋巴细胞。除了发挥直接的抗病毒功能,IFN-γ对免疫应答也起着关键的调节作用。IFN-γ能够上调APC和靶细胞表达主要组织相容性复合物(major histocompatibility complex,MHC)-Ⅰ和MHC-Ⅱ类分子表达,对有效启动免疫应答具有重要意义。最近的一项研究显示,来源于淋巴细胞的IFN-γ能上调单核细胞表面MHC蛋白的表达,MHC则介导了自然杀伤细胞的活化[ 13]。因此推测,IFN-γ在培养体系中的单核细胞和淋巴细胞间的“对话”中可能充当了信号分子媒介的作用,导致淋巴细胞与单核细胞的进一步交互活化。IFN-γ水平上调对T淋巴细胞IL-2表达也可起到促进或互相诱生作用,并诱导Th0向Th1细胞分化。
IL-2是活化的淋巴细胞产生的细胞因子,在淋巴细胞分裂过程中起着关键的作用,是促使淋巴细胞从G1期到S期的重要细胞因子,阻断IL-2对T淋巴细胞的作用,可以抑制T淋巴细胞的活化,并促使T淋巴细胞发生凋亡[ 14];如前所述,EMP可活化T淋巴细胞表达CD69分子。最近Alari-Pahissa等[ 15]认为,CD69可通过IL-2诱导旁观T细胞增殖,这一过程也不会干扰抗原特异性T淋巴细胞的作用。由此推测,我们研究体系中的IL-2也可以进一步活化T细胞产生CD69分子。最近Singleton等[ 16]的研究表明,IL-2诱导的T细胞激酶(interleukin-2 -inducible T cell kinase, Itk)控制T细胞活化的时空构象。同时,IL-2刺激T淋巴细胞MHC-Ⅱ类分子的表达,并产生IFN-γ、IL-4、IL-5、IL-6、TNF-β及集落刺激因子(colony-stimulating factor,CSF)等多种淋巴因子。IL-2还可以促进Th细胞的增殖与分化,能够使活化的B细胞增生产生抗体,是机体免疫反应的重要细胞因子,在机体免疫应答过程中起着关键性作用[ 17]。
根据实验结果,我们认为EMP可通过活化T淋巴细胞并产生一系列生物学效应促进T淋巴细胞介导的细胞免疫应答。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|