作者简介:周丽芳,女,1988年生,硕士,主要从事临床微生物学研究。
通讯作者:赵虎,联系电话:021-62483180。
评估一种全新的幽门螺杆菌(HP)检测方法,即利用多重基因分析系统(GeXP系统)检测HP感染。
方法分别用培养法、快速尿素酶法、普通聚合酶链反应(PCR)和多重基因检测法检测胃活检组织标本中的HP,用Stata 12.0统计软件评估各种方法的敏感性、特异性、阳性预测值、阴性预测值,从检测方法角度横向评估多重基因法检测HP 的有效性;选取16
培养法的敏感性为76.8%,特异性为100.0%,阳性预测值为100.0%,阴性预测值为57.7%;快速尿素酶法的敏感性为87.8%,特异性为80.8%,阳性预测值为93.5%,阴性预测值为67.7%;普通PCR的敏感性和特异性最高,均为100.0%。GeXP系统敏感性和特异性分别为100.0%和71.3%,阳性预测值为90.9%,阴性预测值为100.0%。
结论初步建立的诊断HP感染的多重基因检测法(GeXP系统)具有高敏感性、高特异性以及高通量的特点,不仅可以满足临床标本检测的需求,还可以进行根除治疗后的预后监测,具有很高的临床应用价值。
To evaluate a new kind of
Use culture method, rapid urease test, ordinary polymerase chain reaction (PCR) and multiple genetic testing to determine whether gastric biopsies exist HP. The sensitivity, specificity, positive predictive value and negative predictive value were evaluated by Stata 12.0 statistical software, in order to evaluate the testing performance of GeXP system from horizontal degree. Furthermore, multiple genetic testing was performed by selecting 5 specific genes(16
The sensitivity of culture method was 76.8%, the specificity was 100.0%, the positive predictive value was 100.0%, and the negative predictive value was 57.7%. For rapid urease test, by contrast, its sensitivity was 87.8%, the specificity was 80.8%, the positive predictive value was 93.5%, and the negative predictive value was 67.7%. Ordinary PCR had the highest sensitivity and specificity (100.0%). For GeXP system, the sensitivity was 100.0%, the specificity was 71.3% without false negative case, the positive predictive value was 90.9%, and the negative predictive value was 100.0%.
ConclusionsThe new preliminary multiple genetic testing, GeXP system, has high sensitivity and specificity and high flux characteristics, which would not only meet the needs of clinical sample determination, but also could monitor prognosis after receiving eradication therapy. The GeXP system has a promising application significance.
幽门螺杆菌( Helicobacter pylori, HP)是一种能长期定植于胃黏膜的病原菌。据统计,全球几乎有一半的人群感染此菌[ 1]。1994年,国际癌症研究机构(International Agency for Research on Cancer, IARC)已将其列为人类x02160;类致癌因子[ 2]。HP感染与慢性萎缩性胃炎、消化性溃疡、胃黏膜相关淋巴组织淋巴瘤(mucosal-associated lymphoid tissue ,MALT)和胃癌等发生、发展密切相关,受到临床的广泛关注[ 3]。目前,用于检测HP的方法有多种[ 4],但所有检测方法都存在一定的局限性,因此寻找一种能快速、准确诊断HP感染并作为疗效观察的检测方法尤为重要。本研究建立了一种全新的HP检测方法,即利用多重基因分析技术检测HP感染。
本研究中的胃活检组织标本均来源于华东医院消化内镜室2013年4至8月期间的胃镜检查患者。参与本研究的108例患者均有胃肠道疾患,如慢性萎缩性胃炎、胃溃疡、十二指肠溃疡或胃癌等。其中男60例,女48例,年龄(52.44x000b1;11.73)岁。HP阳性对照菌株NCTC 11637为上海市仁济医院陆红教授惠赠。
1.胃部取材
内镜下距幽门前5 cm大弯或小弯处用活检钳采集黏膜组织2块,置入预先装有运送液(10.0%蔗糖,2.8%布氏肉汤粉,10.0%小牛血清)的0.5 mL离心管,及时送检或4 ℃保存。每份标本均进行快速尿素酶检测、HP培养鉴定、PCR检测和多重基因检测。
2.诊断标准
培养法鉴定出HP或另外3种方法中任意2种诊断方法阳性,即判断为HP感染。
将胃活检组织均匀涂布在哥伦比亚血琼脂培养基(含10.0%无菌脱纤维绵羊血以及10 mg/L万古霉素、5 mg/L甲氧苄啶、2 500 U/L多黏菌素B的抗菌药物混合液),气体条件为5%O2、10%CO2、85%N2,37 ℃温箱培养5~7 d。
1.氧化酶试验
将1%四甲基对苯二胺溶液滴在可疑的菌落上,菌落呈现淡红色x02192;紫红色x02192;紫黑色x02192;最后变为黑色,判定为阳性。
2.过氧化氢酶试验
挑取固体培养基上的菌落1接种环,置于洁净的平皿上,滴加3%过氧化氢水溶液2~3滴,立即观察结果。30 s内出现大量气泡则为阳性,无任何气泡产生为阴性。
3.尿素酶试验
将待检菌株接种于含尿素培养基上,35 ℃培养24 h,观察结果。细菌分解尿素后,使培养基变成碱性,酚红指示剂由黄变红为阳性,不变色为阴性。
将新鲜取出的胃活检组织标本置于培养介质(HP快速检测试剂盒,上海惠太医疗科技公司提供)中,观察指示剂是否变色,若由黄色变为红色则判断有HP感染,否则为无HP感染。
引物设计见表1:
| 表1 普通PCR引物 |
本研究中的引物均是根据GenBank中的标准序列来设计,Blast结果与HP 有很高的同源性。反应条件为:94 ℃预变性3 min;94 ℃变性30 s,60 ℃退火30 s,72 ℃延伸30 s,35个循环;72 ℃温育5 min。PCR产物进行2%的琼脂糖凝胶电泳,于紫外凝胶成像仪下观察结果并拍照。
只有一个混合反应体系并配制如下:加入4 x003bc;L MgCl2溶液,4 x003bc;L 5x000d7;缓冲液,1 x003bc;L混合Forward通用引物,1 x003bc;L混合Reverse通用引物,0.7 x003bc;L Taq酶,9.3 x003bc;L DNA模板。设计的通用引物见表2:
| 表2 多重基因分析系统通用引物 |
对混合体系进行扩增,经反复优化确定扩增条件为:95 ℃预变性10 min,94 ℃变性30 s,55 ℃退火30 s,70 ℃延伸40 s,35个循环。采用多重基因分析系统(美国贝克曼公司生产的GenomeLabTM GeXP)进行毛细管电泳,将1 x003bc;L已标定荧光的DNA片段分离开来。荧光强度由激光来测定。对于扩增的PCR产物,只要其峰面积>10 000,即可判定为阳性检测。
采用Stata 12.0软件进行统计分析。
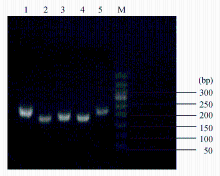
图1是HP阳性对照株NCTC 11637的电泳结果。由图可以看出5种HP的检测基因均有较明亮且单一的条带,说明我们设计的引物、PCR反应体系和反应条件都是有效的。通过扩增其它几种细菌或病毒的DNA模板来评估引物的特异性,结果发现并没有检测出扩增信号,表明5对引物的特异性较好。用此结果作为PCR检测临床菌株的阳性参照。
对于GeXP系统本身的敏感性、特异性,因为 ureC基因在HP内为单拷贝基因,因此本研究通过对该基因进行1~105拷贝稀释梯度以对GeXP系统本身的敏感性进行评估分析。结果表明, ureC基因为10个拷贝时,仍然有可信的峰值。另外我们通过扩增其它几种细菌或人的DNA模板来评估GeXP系统的特异性,结果发现并没有检测出扩增信号,表明该系统高度特异。因此,GeXP遗传分析系统本身的敏感性和特异性均较高。
注:1~5依次为16 S rRNA、 ureC、 ureA、26 KDa、 cagA基因;M为Marker
图2为HP标准菌株NCTC 11637 5种引物多重混合体系GeXP系统检测结果。多重反应体系中包括5种基因的引物,结果中出现了独立分明的5个反应高峰,且峰值均在80 000以上,可以看出来自同一基因组的5种基因的峰面积基本一致,这与理论相符。GeXP系统的基线水平在2 000~3 000范围内,通常基线水平小于5 000同时检测峰大于10 000,说明系统运行稳定且结果可信。这表明上述结果(作为阳性对照)非常好。
表3是4种检测方法检测HP的结果,其中最常用的是快速尿素酶法。结果显示,培养法的敏感性为76.8%,有19株假阴性;该法优点是通常不会出现假阳性,因此特异性很高,本研究评估为100.0%;阳性预测值为100.0%,阴性预测值为57.7%。相比之下,快速尿素酶检测法的敏感性为87.8%,有10例假阴性,因出现5株假阳性(培养法、PCR和GeXP系统均检测为阴性),因此其特异性为80.8%;所得阳性预测值为93.5%,阴性预测值为67.7%。普通PCR的敏感性和特异性最高,均为100.0%。GeXP系统出现8株假阳性,但并未出现假阴性,因此敏感性和特异性分别为100.0%和71.3%;阳性预测值为90.9%,阴性预测值为100.0%。PCR和GeXP系统均有较高的敏感性和特异性。
表4为PCR和GeXP系统对108份标本的检测结果。对于16 S rRNA、 26 KDa、 ureC基因,2种检测方法检测结果较一致,GeXP系统的检测敏感性和特异性均达到了100.0%,因此相应的阳性预测值和阴性预测值也达到了100.0%。 ureA基因的检测敏感性稍低,为95.6%,其特异性为70.4%,相应的阳性预测值和阴性预测值分别为90.6%和82.6%。相比之下, cagA基因的敏感性和特异性分别为85.2%和96.3%,相应的阳性预测值和阴性预测值分别为98.6%和68.4%。不难看出,用多重PCR进行多对基因的检测增加了其检测敏感性和特异性,可以为临床医生提供更加准确的诊断结果。
| 表3 4种检测方法检测HP的结果 |
| 表4 特异引物扩增的不同靶基因进行HP检测 |
目前,至少有7种检测方法可以检测HP:HP培养法、快速尿素酶法、尿素呼气试验、组织切片染色法、PCR、血清法和粪便抗原检测法等[ 5]。但所有的检测方法均存在一定的局限性。血清法不需要取胃活检组织标本即可检测HP,是检测HP最简单的方法,其检测的是体内累积的抗HP抗体,但不能区分是活跃感染还是无症状定植感染[ 6]。相比之下,13C尿素呼气试验敏感性和特异性较高,但当存在其它产尿素酶的细菌时,其特异性将显著下降[ 7]。对于血清法和13C尿素呼气试验等传统的非侵入性方法,虽然具有对人体无创伤,适合儿童、妊娠妇女和高龄老人的多重优点[ 8],但是这些方法只能证明有HP的存在,在一定程度上是定性检测,并不能提供感染菌株的基因型等分子层面的信息,而且容易受HP存活状态、抗菌药物、抑酸剂等因素的影响,从而容易造成假阳性或假阴性。
培养法一向是判断有无HP感染的金标准[ 9],但其培养条件苛刻,阳性检出率低(假阴性率高)[ 10]。目前国内外学者对该方法的评估一般是特异性为100.0%[ 11],通常不会出现假阳性,这与我们的报道相一致。但是该方法极易造成假阴性,因此其敏感性通常在40%~70%之间[ 12],本研究中培养法的敏感性为76.8%,与以往研究并无太大相差。因此虽然培养法可以提供HP感染的最直接和最明确的证据,但因其非常耗时耗力且提供的临床价值少,故一般不作为临床常规检测[ 13]。快速尿素酶法是目前临床上最常规使用的诊断HP感染的方法,但其需要较高的细菌载量,导致无法充分判断其敏感性[ 14]。本研究中,快速尿素酶法的敏感性为87.8%,因出现5株假阳性(培养法、PCR和GeXP系统均检测为阴性),故其特异性为80.8%。所得阳性预测值为93.5%,阴性预测值为67.7%。活检组织标本一般取自胃窦,因为该处的胃黏膜组织通常无其他杂菌生长,而且活动期的HP多聚于此,HP的相对密度较大,适合作快速尿素酶检测。但是,该法受细菌载量影响较大,国外有学者研究,需要105载量的HP才能得到较可靠的诊断结果[ 15],因此对于不同的患者以及处于不同感染期的患者,该方法容易产生假阴性,其敏感性并不高[ 16]。另外对细菌载量的要求也导致该法不能对患者作根除治疗后的跟踪与监测[ 17]。
组织切片染色法是最常用的诊断方法之一,但是若想得到较准确的结果需达到2个基本要求:首先是获得高质量的活检组织标本(但实际操作中不易获得);其次是HP载量不能太少(同样很难把握),否则染色后没有较为典型的HP的多态性,从而不易判定结论[ 18],另外显微镜观察时还可因为主观因素造成假阴性或假阳性[ 19]。除此之外,其他因素诸如HP菌株在胃各部的分布、密度以及染色方法的选择都会直接影响诊断结果[ 20]。因此本研究并未选择该方法作为参照。
分子生物学方法中PCR可以检测微量DNA模板,而且敏感性和特异性均较高,对活检组织标本的HP载量要求较低,可以用于快速灵敏检测,而且该方法可以检测HP的致病基因和耐药基因的特异突变位点[ 21]。本研究选用了5种最常用的HP检测基因用来做PCR检测和GeXP系统检测的比较分析,并以研究较为成熟的PCR作为判断标准。因PCR可以灵敏地识别较微量的DNA,因此该法受HP载量以及存活状态影响非常小,故该方法检测HP的敏感性和特异性均较高,都达到了100.0%,相应的阳性预测值和阴性预测值也为100.0%。但该方法只能在基因型方面做定性检测,不能做定量分析,更不能做高通量检测,如果用于临床HP的常规检测,仍然显得不够灵活和方便,因此该方法目前仍主要用于科研领域[ 22]。
本研究初步建立了一种全新的HP检测方法,即利用多重基因分析技术(GeXP系统)检测HP感染。GeXP系统是一种多重PCR遗传分析系统,其工作原理为利用通用引物将HP DNA模板扩增,所得PCR产物的头端及尾端都含有通用标签,再以通用正向引物(标记D4荧光剂)及通用反向引物将这些产物以PCR放大, 此时每个不同大小的PCR产物在头端都含有D4荧光,最后利用毛细管电泳的技术将这些已标定荧光的DNA片段分离开来并对数据进行分析,具有很高的敏感性、特异性及精确度,并且可以实现相对定量和高通量检测,成本较低,非常符合临床应用。本研究中,从标准菌株的基线图和结果图来看,该系统检测非常稳定。根据系统本身的特性,通常基线值<5 000且10 000<纵坐标x000d7;50%(峰面积)<120 000即表明系统运行稳定且检测结果可信。图3中,纵坐标值均在150 000以上,而且在5对引物的混合体系条件下,各峰均独立明确,峰面积值几乎相等,符合判断标准。该系统能够灵敏特异地识别非常微量的DNA检测标本,根据对GeXP系统本身的敏感性分析得到,该系统最少可以检测到10拷贝的目的DNA量,是普通PCR的10~100倍,敏感性非常高,因此在表4中,虽然GeXP系统有8例假阳性,但很可能是因为HP的载量太少,以至于其它方法都不能检测到,但是根据我们所定的金标准,只能将这8例归为假阳性;通过扩增其它几种细菌或病毒的DNA模板来评估GeXP系统的特异性,结果发现并没有检测出扩增信号,表明该系统高度特异。由图2可以看出,检测结果非常直观,显示了很好的应用前景。GeXP系统可以同时检测多种检测基因,而且各基因的敏感性和特异性均较高(多种基因可以达到100.0%)。本研究中,用GeXP系统检测的5对引物就是在一个体系中单独完成的。以此分析,该方法不仅保证了较高的检测准确度,重要的是,为临床提供了更广泛并且更准确的标本选择,因为对于不同年龄段、不同临床症状乃至不同生活习惯的患者,可能会对不同的诊断基因(和致病基因)有所倾向,而这也是我们下一步研究的方向。
总之,我们初步建立了一种新的多重PCR遗传分析系统来诊断HP感染。该系统不仅有较高的检测敏感性和特异性,还可以进行高通量检测,每次可以加96个标本体系,每个体系中可以加30多对引物而彼此之间不受影响,不仅满足了临床标本检测的需求,同时可以通过定量、检测突变位点来分析HP的致病程度、耐药情况以及进行HP根除治疗后的预后监测,具有很高的临床应用价值。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|