作者简介:韦善求,女,1964年生,学士,副主任技师,主要从事血液学检验工作。
通讯作者:兰江,联系电话:0771-5620119。
探讨获得性免疫缺陷综合征(AIDS)合并马尔尼菲青霉病(PSM)的实验室诊断方法。
方法采用回顾性研究对257例AIDS患者骨髓和血液真菌培养以及骨髓涂片镜检检测马尔尼菲青霉(PM)的结果进行统计分析。
结果共检出PM 77例,检出率为29.96%。血液及骨髓真菌联合培养检出PM 74例,其中骨髓及血液培养检出PM的病例数分别为65例和54例;骨髓涂片镜检检出PM 33例,其中30例经培养证实PM感染,3例培养结果阴性但临床资料支持PM诊断。以血液及骨髓联合培养阳性为金标准,AIDS患者骨髓及血液真菌培养PM检出率分别为87.84%和72.97%,2种培养方法之间及其与2种方法联合培养比较,差异均有统计学意义(
联合骨髓和血液真菌培养并结合骨髓涂片镜检检测PM,对提高AIDS患者合并PSM诊断的及时率和阳性检出率有重要意义。
To investigate the laboratory diagnosis methods of acquired immune deficiency syndrome (AIDS) combined with penicilliosis marneffei (PSM).
MethodsA total of 257 AIDS patients were enrolled. Bone marrow and peripheral blood fungal dimorphic culture and bone marrow smear microscopy were performed for the detection of
The 77 AIDS patients had PM, and the detection rate was 29.96%. A total of 74 patients were identified by bone marrow and peripheral blood fungal dimorphic culture, including 65 patients were positive in bone marrow, and 54 patients were positive in peripheral blood. A total of 33 patients were proved to be PM positive by bone marrow smear microscopy, including 30 patients showed positive in fungal dimorphic culture, and 3 patients showed negative but positive during therapeutic diagnosis. With the positivity of bone marrow fungal and peripheral blood fungal dimorphic culture as the good standard for PM diagnosis, the detection rate of PM by bone marrow fungal culture was 87.84%, which was significantly higher than the detection rate by peripheral blood fungal culture among AIDS patients (72.97%). The 2 individual culture rates were significant statistically with the rate of dimorphic culture (
The detection of PM by bone marrow and peripheral blood fungal dimorphic culture combined with bone marrow smear microscopy is significant in the diagnosis of AIDS combined with PM on time.
马尔尼菲青霉病(penicilliosis marneffei,PSM)是由马尔尼菲青霉( Penicillium marneffei,PM) 引起的一种少见深部真菌感染,主要在东南亚地区如泰国、越南、印度、老挝、柬埔寨以及中国广东、广西等地流行。多年来一直认为竹鼠可能与人感染PM有关,近年研究发现广东及广西地区的PM分离率为70%~100%[ 1, 2],且与临床人PM分离株在流行病学、超微结构、微卫星基因片段方面具有极高的相似性[ 2, 3]。目前,PSM 已成为东南亚地区获得性免疫缺陷综合征(acquired immune deficiency syndrome,AIDS)患者最常见的机会性感染之一,在机会性感染中PM感染率已升至第3位[ 4]。PM具有嗜单核-巨噬细胞系统倾向,侵袭力强,可侵犯机体的肺、肝及脾等多个脏器并极易侵入血液循环大量增殖[ 5],形成菌血症并导致多器官播散性感染。该病病情发展迅速[ 6],如治疗不及时病死率很高[ 7],而早期诊断并给予二期预防性治疗,则通常可以获得较好的疗效[ 8, 9]。由于AIDS合并PSM缺乏特征性表现,临床诊断主要依据病原学,实验室的检测能力对其治疗转归意义重大。现将南宁市第四人民医院257例AIDS患者骨髓和血液真菌培养以及骨髓涂片镜检检测PM的结果进行回顾性分析,以探讨提高AIDS合并PSM的实验室诊断方法。
257例患者均为2010年1月至2012年5月在南宁市第四人民医院感染科住院并已确诊为AIDS的患者,其中男212例,女45例,年龄(42.0±0.96)岁。所有病例均于抗真菌治疗前采集血液和骨髓分别进行真菌培养,同时制作骨髓涂片进行细胞学分析。AIDS诊断标准符合2006年中华医学会感染病学分会艾滋病学组制定的AIDS诊疗指南,所有病例均经过广西壮族自治区疾病预防控制中心艾滋病确证实验室确证。
1.PM培养及鉴定 标本接种于血培养瓶(法国生物梅里埃公司)置于血培养仪(BAcT/ALERT 3D)中培养,仪器阳性报警后转种血平板(哥伦比亚)和2份沙保罗培养基(杭州天和公司)上,沙保罗培养基分别置25和35 ℃孵育,连续观察2~7 d。阴性标本继续放35 ℃温箱培养到12 d,再用血平板和沙保罗培养基盲转置25和35 ℃培养2 d,无细菌生长报告阴性。
PM的鉴定:在沙保罗培养基上35 ℃培养呈膜样、湿润、平坦、最初为灰白色酵母样菌落,48 h后菌落渐呈淡褐色、玫瑰红色,背景顔色较深,菌落直径约0.5~1.0 cm,镜下可见2.5~3.0 μm圆形、椭圆形酵母样细胞,也可见关节孢子,呈单细胞性;25 ℃培养初期为浅灰色具有白色绒毛的丝状菌落,72 h后渐呈淡黄、黄绿以至棕色,培养基呈玫瑰红色,镜下可见分生孢子梗分枝,梗顶端生有典型帚状枝,分生孢子光滑椭圆或球形,大小约(2.0~3.0 μm)×(1.9~2.3 μm)。
2.骨髓涂片镜检查找PM 常规无菌采集骨髓,涂片2~5张,采用瑞氏—姬姆萨染色,根据骨髓取材满意度标准评判取材是否合格。油镜下PM呈类圆形、长圆形或腊肠形,大小不一,约2 μm×8 μm ,胞膜不甚清楚,有1~2个紫红色小核,浆淡蓝色。菌体分裂前可见胞体变长,两端钝圆,形似腊肠,中部形成半透明横隔,是诊断PM的主要特征。
运用SPSS 11.0 统计软件进行 χ2检验,以 P<0.05为差异有统计学意义。
257例AIDS患者共检出PM 77例,检出率为29.96%。血液及骨髓联合培养法共检出PM 74例,骨髓及血液真菌培养PM阳性病例数分别为65例和54例,2种培养结果均阳性45例,骨髓培养阳性而血液培养阴性20例,血液培养阳性而骨髓阴性9例。以血液及骨髓联合培养阳性为标准,骨髓及血液培养PM的检出率分别为87.84%(65/74)和72.97%(54/74),两者间及其与两者联合培养比较,差异有统计学意义( 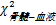


| 表1 257例AIDS患者培养法PM检测结果 |
镜检法检出PM 33例,其中30例与培养结果相符,3例培养结果阴性但患者临床症状符合菌血症特征,抗真菌治疗有效。以培养结果为标准,本组病例骨髓涂片镜检诊断PSM的特异性为90.91%(30/33),敏感性为44.59%(33/74),结合骨髓涂片镜检分析,血液及骨髓联合培养法诊断PSM的漏检率为3.90%(3/77)。
人类感染PM的途径尚未完全明确,一般认为环境中的PM孢子可能通过呼吸道、消化道和破损的皮肤等途径进入机体。本组病例PM检出率为29.96%,较唐秀文等[ 10]所报道的痰、咽拭子、脑脊液、血液及淋巴结组织等标本22.34%的检出率高,说明AIDS患者常合并PM感染且易侵犯血液及骨髓。因而,快速、有效地检测AIDS患者是否受PM感染对及时采用合适的治疗方案至关重要。
血液与骨髓真菌培养联合检测PM是必要的,两者具有互补性。AIDS患者感染PM后常导致单核—巨噬细胞系统反应性增生,由于PM的嗜性特点是极易侵犯血液及骨髓,故血液和骨髓真菌培养是检测PM的有效方法。PM播散性感染早期先进入血液循环,当血液中的PM尚未侵犯骨髓时可出现血液培养阳性而骨髓真菌阴性的结果。当PM侵犯骨髓后,由于骨髓中的网状细胞吞噬活跃,常常将PM吞噬使之聚集于细胞内。AIDS患者因为细胞免疫功能低下,使依赖于T细胞激活的网状细胞不能将吞噬于细胞内的PM杀灭,反而对药物起屏障作用,这些因素可能是一些患者骨髓真菌培养PM阳性而血液培养PM阴性的原因。本研究PM培养阳性病例中骨髓培养阳性而血液培养阴性20例,血液培养阳性而骨髓培养阴性9例。说明对于AIDS患者采用培养方法诊断PSM时血液培养法和骨髓培养法不能相互替代,两者有明显互补作用,联合检测可有效降低漏检率。
骨髓涂片镜检诊断PSM速度快、特异性高,对培养法的漏检缺陷有一定弥补作用。PM培养生长较缓慢,骨髓及血液培养通常需要7~14 d。由于实验室检测方法的局限性,制约了PSM的治疗转归。为此,临床迫切需要建立一种快速、灵敏、特异的PM检测方法。PM的快速检测包括骨髓涂片、聚合酶链反应(polymerase chain reaction, PCR)、1,3-β-D-葡聚糖试验(简称G试验)等方法。陈万山等[ 11]采用PCR检测血液标本中的PM,特异性为100.0%,而敏感性仅为9.5%;梁义等[ 12]通过定量检测播散性PSM动物血浆1,3-β-D-葡聚糖浓度以诊断真菌感染,特异性及阳性预测值均为100.0%,敏感性为88.3%,而阴性预测值只有58.8%。G试验对真菌性感染的检测敏感性高,但假阳性不易控制,且不能鉴定真菌的种属,因此用于PSM的诊断价值有限。骨髓涂片中PM形态较易识别[ 13],诊断PSM快捷、不需要特殊设备,经过技术培训,可以在各级医院开展。本研究中有3例镜检法PM阳性而培养结果阴性,患者临床表现符合菌血症特征,抗真菌治疗有效,推测该3例患者也受PM感染。若以培养结果结合临床特征,骨髓涂片检测PM的敏感性达42.86%(33/77),特异性为100.0%,这意味着该方法可以使将近一半的PSM患者提前7~10 d得到治疗,这对一些患者来说可能意义重大。
AIDS患者免疫能力低下,常合并多种感染,部分患者在入院前已经使用了多种抗菌药物,如果是使用了对真菌敏感的药物,则真菌培养可能出现假阴性结果。本研究涂片镜检与培养结果比对提示,培养方法诊断PM感染存在一定漏检缺陷,骨髓涂片镜检法对培养法的漏检有一定弥补作用。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|

