作者简介:崔凡,男,1968年生,硕士,主任技师,主要从事临床生化、分子生物学检验工作。
观察射频导管消融术(RFCA)对患者术后部分凝血与纤溶指标变化的影响,以及术后恢复时间。
方法对56例接受RFCA治疗的患者,在RFCA前、心内电生理检查后、成功消融后即刻、术后第2天和第7天抽取静脉血,测定D-二聚体(DD)、血管内血友病因子(vWF)、血浆组织纤溶酶原(t-PA)和组织纤溶酶原抑制物(PAI-1)含量。
结果与术前比较,血浆DD、vWF浓度以及血浆PAI-1含量在心内电生理检查后、消融成功后即刻和术后第2天均显著上升(
RFCA可引起血液中部分凝血与纤溶物质水平显著增加,术前、术后对其监测有利于指导抗凝药物应用和预防血栓栓塞的发生。
To observe the changes of blood coagulation and fibrinolytic indices after radiofrequency catheter ablation(RFCA) and the restoring time after RFCA.
MethodsThe levels of D-dimer (DD), von willebrand factor (vWF), tissue plasminogen activator (t-PA) and plasminogen activator inhibitor (PAI-1) were determined in 56 patients undergoing RFCA after intracardiac electrophysiological study before RFCA, just at the time after RFCA and in 2 d and 7 d after RFCA.
ResultsThe levels of DD, vWF and PAI-1 increased significantly after intracardiac electrophysiological study before RFCA, just at the time after RFCA and in 2 d after RFCA (
RFCA may increase the levels of blood coagulation and fibrinolytic indices. Monitoring the levels of D-dimer, vWF, t-PA and PAI-1 is valuable in guiding the administration of anticoagulative drugs and the prophylaxis of thromboembolic events.
射频导管消融术(radiofrequency catheter ablation,RFCA)是根治某些快速性心律失常的一种安全有效的介入治疗方法[ 1],然而在RFCA术中、术后发生栓塞并发症的现象也屡有报道[ 2]。为揭示产生这一负面作用的机制,我们对56例患者RFCA术前、术中及术后血浆D-二聚体(D-Dimer,DD)、血管内血友病因子(vonwille-brandfactor,vWF)以及血浆组织纤溶酶原(tissue plasminogen activator,t-PA)、组织纤溶酶原抑制物(plasminogen activator inhibitor,PAI-1)含量进行动态观察。
2010至2012年在芜湖市第一人民医院行RFCA治疗的56例患者,术前检查无血栓栓塞疾病和出血性疾病病史。其中男32例,女24例,平均(38.0±10.8)岁。
采用经皮穿刺股静脉或/和股动脉、左锁骨下静脉进行电生理检查,明确诊断后经股静脉或股动脉插入8F大头导管标测消融。分别于插管前、电生理检查后、放电消融成功后即刻、术后第2天、术后第7天采用酶联免疫吸附试验(enzyme-linked immunosorbent assay, ELISA)检测血中DD、vWF、PAI-1及t-PA含量。试剂盒由上海生物太阳公司提供。
采用SPSS 6.0软件进行统计,所有计量资料以 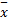
在电生理检查后DD浓度及vWF明显升高( P<0.01),放电后两者迅速升至高峰浓度。以后逐渐下降,至术后第2天其浓度仍高于插管前水平( P<0.01),至术后第7天两者均恢复至术前水平。见表1:
表1 RFCA前后DD、vWF、t-PA和PAI-1的动态变化 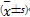 |
在电生理检查后t-PA含量即有明显下降( P<0.01)。放电后下降更为明显,至术后第2天达到最低谷浓度,直至术后第7天方恢复至术前浓度水平,而PAI-1则在电生理检查后迅速上升( P<0.01),在放电后继续上升( P<0.01),术后第7天逐渐下降至术前水平。见表1。
RFCA自1987年应用于临床以来,已成为一种安全、有效的根治某些快速性心律失常的首选方法。但对于可能伴发的血栓栓塞,尽管术前采取某些预防措施,仍不断发生[ 3]。发生栓塞的机制,可能与导管消融影响血管内皮功能及内源性纤溶系统活性有密切关系。
DD是纤维蛋白单体经活化因子交联后,再经纤溶酶水解产生的一种特异性降解产物,Ay等[ 4]的研究显示其浓度增高表明凝血酶生成多和继发性纤溶活性高,可作为体内高凝状态分子标志物之一。同时国内学者研究表明t-PA及PAI-1的含量可特异地、敏感地反应纤溶系统的活性程度[ 5]。而Tanaka等[ 6]认为vWF是目前反映内皮细胞功能最好的指标,它介导血小板黏附/聚集,具有促凝血作用,从而促发血栓形成。我们的观察表明RFCA术中、术后血液处于高凝状态,并证实在插管后、电生理检查后,DD、vWF及PAI-1都明显升高,且放电消融后升至高峰,此后逐渐下降,至术后第7天恢复至术前水平,由此推测RFCA术后发生血栓栓塞可能机制为:(1)手术过程中损伤了血管内膜和心内膜,暴露出内膜下组织,引起血小板黏附、聚集和纤维蛋白形成,机体溶解纤维蛋白消耗大量的t-PA,导致t-PA含量下降,而内皮系统损伤又反过来激活血小板,释放大量PAI-1,进一步抑制t-PA,增加血栓形成;(2)放电消融时引起局部心内膜和心肌损伤,加重血小板激活和纤溶系统损害,使血液处于高凝状态[ 7]。术中诱发室上速致机体应激状态增强及术中血管迷走反射、血容量不足等因素均导致血小板激活增强[ 8]。由此可见,RFCA可造成血管内皮损伤和纤溶系统破坏,有发生栓塞的可能性,因此在RFCA术中应做到导管操作轻柔,减少靶点放电次数,合理控制射频能量、放电时间及温度和阻抗,缩短手术时间,以及术前、术中、术后抗凝,有助于减少血栓栓塞的形成。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|

