肠球菌属细菌作为一种条件致病菌已成为医院感染, 尤其是尿路感染的重要病原体之一。临床上常见的肠球菌属细菌为粪肠球菌和屎肠球菌。氨基糖苷类与作用于细菌细胞壁抗菌药物的联合应用是治疗肠球菌感染的主要手段。一旦肠球菌对氨基糖苷类高水平耐药, 则协同作用消失[ 1]。为了解粪肠球菌和屎肠球菌耐药性特征的变化情况, 以指导临床合理使用抗菌药物, 及时控制医院感染, 我们对从尿路感染患者中段尿中分离出的23株粪肠球菌和18株屎肠球菌进行细菌耐药性检测, 并分析其相关的耐药基因。
收集2012年1至10月安图医院检验科从尿路感染患者中段尿标本中分离出的41株肠球菌, 其中粪肠球菌23株 (56.1%)、屎肠球菌18株 (43.9%)。同一患者连续分离出相同菌株, 取首次分离菌株。菌种鉴定采用 API板条 (法国生物梅里埃公司) 进行鉴定。
采用纸片扩散法, 试验方法与判断标准依据美国临床实验室标准化协会 (Clinical and Laboratory Standards Institute, CLSI) 2012年版规定[ 2]。 药物敏感性纸片、羊血琼脂平板、水解酪蛋白胨琼脂均为科玛嘉公司产品。
1. 引物设计与合成 7种耐药基因包括氨基糖苷类药物耐药基因aac(6′)/aph(2′) 、ant(6)-Ⅰ、aph(3′)-Ⅲ, 红霉素耐药相关基因ermB,四环素类药物耐药基因tetM,万古霉素耐药基因vanA、vanB。在GenBank中查询肠球菌属的耐药基因的基因序列, 运用Primer Primer 5.0序列分析软件设计引物, 选择最佳的引物进行后续研究。由Invitrogen公司合成。基因序列见表1:
| 表1 肠球菌耐药基因引物序列 |
2. 肠球菌属DNA的提取 取纯培养菌落悬于细菌培养液1~5 mL, 11 500×g离心1 min后取沉淀, 使用北京天根生化科技有限公司的TIANGEN 细菌基因组DNA提取试剂盒 (离心柱型) 提取肠球菌属DNA,-20 ℃备用。
3. 聚合酶链反应 (polymerase chain reaction, PCR) 扩增 按照北京天根生化科技有限公司的PCR反应试剂盒2×Taq MasterMix说明书配制反应体系, 各种耐药基因扩增的循环参数为:95 ℃预变性5 min;94 ℃ 30 s, 60 ℃ 40 s, 72 ℃ 40 s, 循环35次;72 ℃延伸7 min。
4. 扩增产物分析 扩增产物进行琼脂糖凝胶电泳, 经DNA Green染色后在紫外光下观察电泳结果, 采用凝胶图像分析系统摄像保存。
5. 阳性基因测序 测序由Invitrogen公司完成。测序结果采用美国国立生物技术信息中心的Blast软件分析。
采用SPSS 13.0软件进行χ2检验,P<0.05为差异具有统计学意义。
屎肠球菌对青霉素、氨苄西林、环丙沙星、左氧氟沙星、红霉素的耐药率为100.0%,粪肠球菌对青霉素、四环素、环丙沙星、左氧氟沙星、红霉素的耐药率>50.0%,粪肠球菌和屎肠球菌的耐高浓度庆大霉素的检出率分别为56.5%和55.6%。屎肠球菌对青霉素、氨苄西林的耐药性较粪肠球菌高(P<0.01);屎肠球菌对红霉素、环丙沙星和左氧氟沙星等抗菌药物的耐药性与粪肠球菌比较差异无统计学意义(P>0.05) 。未检出耐万古霉素的肠球菌。41株肠球菌对11种抗菌药物的耐药率见表2:
| 表2 肠球菌对11种抗菌药物的耐药率 |
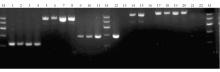
1. 肠球菌属耐药基因检测 41株多耐药肠球菌中, 阳性基因aac(6′)/aph(2′) 、aph(3′)-Ⅲ均检出41 株, 检出率均为100.0%;ant(6)-Ⅰ基因检出40株, 检出率为97.6%;ermB基因检出29株, 检出率为70.7%;tetM基因检出15株, 检出率分别为36.6%;vanA和vanB基因检出0 株, 检出率均为0.0%。部分耐药肠球菌的PCR产物电泳凝胶成像图见图1。大多数菌株存在≥2种耐药基因。分离出的23株粪肠球菌中,tetM、ermB、aac(6′)/aph(2′) 、ant(6)-Ⅰ、aph(3′)-Ⅲ基因阳性检出率分别为65.2%、82.6%、100.0%、100.0%和100.0%; 分离出的18株屎肠球菌中,tetM、ermB、aac(6′)/aph(2′) 、ant(6)-Ⅰ和aph(3′)-Ⅲ基因阳性检出率分别为55.5%、55.5%、100.0%、94.4%和100.0%。
2. 肠球菌属耐药表型与基因型比较 41株进行基因检测的多药耐药肠球菌中, 对氨基糖苷类药物的耐药表型与基因型符合株有24株, 符合率为58.5%;红霉素类耐药表型与ermB基因型符合株有30株, 符合率为78.9%;四环素类耐药表型与tetM基因型符合株有34株, 符合率为61.8%。
3. 阳性基因的测序 本研究的阳性基因的测序结果经过NCBI的Blast软件分析, 并与NCBI已登录的相应基因序列相比较, 结果一致。
近年来肠球菌属作为条件致病菌所致的感染率持续升高, 尤其对于那些有严重基础疾病、机体免疫力低下的患者, 容易侵入体内或易位, 导致局部或全身感染。肠球菌由于其细胞壁厚, 对多种抗菌药物呈现固有耐药。美国医院感染监视系统已将其列为医院感染的第二大病原菌[ 3]。本研究分析了安图医院尿路感染患者中段尿中分离出的肠球菌属细菌的耐药率及其相关的耐药基因。结果显示分离出的肠球菌属以粪肠球菌多见, 占56.1%;屎肠球菌占43.9%。体外药物敏感性试验结果显示, 屎肠球菌对青霉素和氨苄西林的耐药率均为100.0%,粪肠球菌对青霉素和氨苄西林的耐药率分别为52.2%和21.7%,未检出耐万古霉素的肠球菌属, 与其他报道[ 4]有一定的差异, 可能是由于菌株来源地区不同所致。另外, 本研究药物敏感性试验结果显示, 粪肠球菌和屎肠球菌的耐药情况严重, 其中屎肠球菌的耐药性比粪肠球菌要严重得多, 与文献报道[ 5, 6]一致。屎肠球菌对青霉素、氨苄西林、环丙沙星、左氧氟沙星和红霉素的耐药率明显高于粪肠球菌, 提示临床对于屎肠球菌感染的经验治疗应避免使用上述药物。未发现对万古霉素耐药的菌株, 提示万古霉素等糖肽类抗菌药物仍是临床治疗肠球菌感染的最有效药物。但是随着万古霉素的大量应用, 耐万古霉素肠球菌的感染逐渐增多, 这就要求我们一方面要不断完善实验室对耐万古霉素肠球菌的检测, 另一方面还应加强临床对抗菌药物使用的管理, 尤其严格万古霉素等糖肽类抗菌药物使用的适应征, 防止和减缓耐万古霉素肠球菌的产生[ 7]。
肠球菌对氨基糖苷类药物的耐药机制主要是产生质粒介导的氨基糖苷类修饰酶, 以aac(6′)/aph(2′) 、ant(6)-Ⅰ和aph(3′)-Ⅲ等基因型为常见。本研究41株临床分离株中aac(6′)/aph(2′) 和aph(3′)-Ⅲ基因在粪肠球菌和屎肠球菌阳性率均达到100.0%,ant(6)-Ⅰ基因阳性率为97.6%。研究粪肠球菌与屎肠球菌表型与基因型的关系发现, 氨基糖苷类药物的耐药表型与基因型符合率为58.5%,屎肠球菌与粪肠球菌存在表型为敏感而检出耐药基因的情况, 可能与基因未表达或表达不完全有关。研究表明氨基糖苷类修饰酶基因在临床分离肠球菌中的存在状况十分广泛, 耐药情况严重。
红霉素耐药相关基因ermB的检出率达70.7%,erm(ermA、ermB)基因表达红霉素核糖体甲基化酶, 使细菌核糖体红霉素作用靶位点发生甲基化, 从而耐红霉素。细菌一旦获得erm基因, 将对大环内酯类-林可酰胺类-链阳菌素B耐药[ 8]。红霉素类耐药表型与ermB基因型符合率为78.9%。
四环素类药物耐药机制有2类, 一类为产核糖体保护蛋白;另一类为产TET外排泵蛋白。肠球菌属可以通过获得tetM基因表达核糖体保护蛋白使其免受四环素类抗菌药物的作用[ 9]。本研究中四环素类药物耐药基因tetM阳性率为36.6%。四环素类耐药表型与tetM基因型符合率为61.8%。
临床分离的粪肠球菌和屎肠球菌在泌尿系统的感染最为常见, 屎肠球菌对临床常用抗菌药物的耐药率高于粪肠球菌, 且多药耐药和高耐现象相当严重。肠球菌对氨基糖苷类药物的耐药机制主要由aac(6′)/aph(2′) 、ant(6)-Ⅰ、aph(3′)-Ⅲ基因介导, 产生ermB基因则是肠球菌对大环内酯类药物耐药的主要原因, 肠球菌携带tetM基因并表达是对四环素耐药的主要原因。在治疗时, 应根据耐药特点及菌种间的耐药性差异来选择相应的治疗方案。目前万古霉素和利奈唑胺仍然是治疗肠球菌感染的最好药物。加强细菌耐药基因检测, 对于科学制定抗菌感染治疗方案以提高救治成功率, 并为细菌耐药性监测及流行病学调查提供分子生物学依据具有实际意义。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|