朱晶,女,1984年生,学士,技师,主要从事临床生化检验工作。
潘柏申,联系电话:021-64041990-2376。
2. 不合格血液标本的处理 检验科工作人员发现不合格标本后,立即电话告知病区护士,包括患者信息、标本信息和不合格原因。由病区判断需要将此标本进行撤单,或需重新采血,并进行记录。2010年起本实验室改用信息管理系统电子记录取代原来的纸质记录,且能一并作退费处理。
分析不合格血液标本产生的原因和制定相应对策,确保分析前环节的标本质量。
方法回顾性分析2008年至2012年复旦大学附属中山医院检验科接收住院患者不合格血液标本5 933例。以不合格率描述不合格标本的情况,采用PearsonX2检验比较不同种类的抗凝管发生标本凝块和标本量少的风险。
结果2008年至2012年真空采血系统采集的血液标本的不合格率分别为1.49 ‰、0.76 ‰、0.52 ‰、0.50 ‰和0.47 ‰,呈现明显的下降趋势;血液标本的6大不合格原因依次为标本凝块、标本量少、标本抽错管、条码问题、送检超时和重复采血。其中以柠檬酸钠抗凝管发生标本凝块和标本量少的情况最多。
结论检验科需加强与护理部和临床部门之间的联系,及时沟通反馈不合格标本的情况,寻找原因并制定和实施改善措施,共同努力确保分析前环节的血液标本质量。
To analyze the cause and countermeasure of the rejection of blood specimens, and to find solutions to decrease the number of rejected blood specimens for laboratory quality improvement.
MethodsA total of 5 933 rejected blood specimens were analyzed retrospectively from 2008 to 2012 in Department of Clinical Laboratory, Zhongshan Hospital, Fudan University.
Resultswere shown by the frequency of rejected blood specimens in which Pearson X2 test was used to evaluate the percentages of clotted specimens and insufficient specimens with different types of tubes.
ResultsThe frequencies of rejected blood specimens from 2008 to 2012 were 1.49 ‰, 0.76 ‰, 0.52 ‰, 0.50‰ and 0.47‰, respectively, with decreasing tendency. The 6 major causes of rejection were clotted blood specimen, insufficient blood volume, inappropriate anticoagulant, error in sample identification, specimen transfer overtime and repeated blood collection. Clotted blood specimen and insufficient blood volume were common in sodium citrate anticoagulant tube specimens compared with others.
ConclusionsClinical laboratories should strengthen the ties with the nurses and clinical doctors whom would be informed with the rejection of blood samples in time, in order to figure out and carry out the solutions, reduce the number of rejected blood specimens and improve the pre-analytical quality.
医院检验科在患者的诊断和疗效监测方面都发挥了越来越重要的作用,检验报告的准确性和及时性不仅体现了检验科在分析前、分析中和分析后各个环节对于检测质量整体把握,也体现了对于差错报告的监管和控制能力。已有研究表明随着近年来检测技术的不断发展,分析前环节中的差错占到了检测结果误差的近70 %[
本研究通过回顾性分析2008年至2012年复旦大学附属中山医院检验科收集的不合格血液标本情况,进行不合格原因分析、制定的相应措施,以及实施后效果的探讨。
1. 标本来源
收集复旦大学附属中山医院检验科2008年1月至2012年12月所记录的病区不合格血液标本5 933 例,进行回顾性分析。血液标本均由病区护士采集,医院工勤人员负责将标本送至检验科。
2. 试剂
血液标本均采用美国BD公司生产的真空采血管采集:含分离胶及促凝剂的血清管、柠檬酸钠抗凝管、乙二胺四乙酸(ethylenediaminetetraaceticacid,EDTA)-K2抗凝管、肝素抗凝管、氟化钠抗凝管。
1. 不合格血液标本判断 检验科采用的不合格血液标本判断标准 (1)标本凝块:血清或抗凝血标本中有凝块;(2)标本量少:标本采集量无法满足检测需求或抗凝标本采血量未达刻度要求;(3)采血管错误:使用了错误的真空采血管;(4)真空采血管破损;(5)送检超时:标本采集后未在规定时间内送检;(6)标本信息有误:患者信息有误、无检测项目等;(7)无标本;(8)溶血:影响检测结果的中度和重度溶血;(9)严重脂血:白色、牛奶状脂血;(10)标本污染:补液静脉处采血、标本运送途中因未加盖受到其他标本的污染等。凡符合以上任一种情况即判定为不合格血液标本。
2. 不合格血液标本的处理 检验科工作人员发现不合格标本后,立即电话告知病区护士,包括患者信息、标本信息和不合格原因。由病区判断需要将此标本进行撤单,或需重新采血,并进行记录。2010年起本实验室改用信息管理系统电子记录取代原来的纸质记录,且能一并作退费处理。
采用Excel 2007软件统计不合格血液标本量和不合格血液标本率。不合格血液标本率=不合格血液标本数/血液标本总数1 000 ‰。采用SPSS 16.0软件进行统计分析, P<0.05为差异有统计学意义。
结果
2008年至2012年不合格血液标本率呈逐年下降趋势,2009年下降幅度最为明显。通过每月记录不合格标本情况、整理和分析不合格血液标本产生的原因;并有的放矢地制定和落实改善措施;加强与护理部以及实验室信息管理人员间的沟通,本实验室的血液不合格标本情况得到了明显改善。2012年的血液不合格标本率已下降至0.47‰,见表1:
| 表1 2008年至2012年血液不合格标本率(‰) |
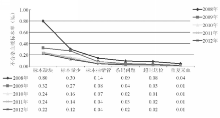
2008年至2012年不合格血液标本的6大原因依次为标本凝块、标本量少、标本抽错管、条码问题、送检超时和重复采血,均呈逐年下降,见图1:
注:不合格率为不合格血液标本数占血液标本总数的千分比
1.标本凝块
从图1中可见虽然各原因导致的不合格血液标本率均在不断下降,但其中标本凝块始终是首要原因。通过走访病房,与临床一线的护理人员直接沟通了解到,抗凝血标本发生凝块的原因之一是由于有些病情危重或年老患者本身静脉的状态不佳,抽血难度较大;还可能由于采血人员经验不足、操作不当,等待真空管负压充盈的时间相对较长;或在采血后没有及时将血液与抗凝剂充分混匀,就可能出现肉眼可见或不可见的凝块,影响检测结果。对于这些情况,采血时需注意选择更为合适的静脉;采血后需立即将标本轻柔地颠倒混匀35次,使血液标本及时与抗凝剂充分混匀,才能避免发生标本凝块。此外对于促凝血清管而言,凝块主要发生在血透患者或血液处于高凝状态的患者标本,多次离心也无法完全去除凝块。由于可能影响检测仪器吸样的准确性,因而也属于不合格标本。针对这类情况建议更换肝素抗凝管采集标本,能有效减少此类不合格标本。
2.标本量少
通过病区走访实地考察了解到,除了患者血管状况不佳、采血人员技术等原因之外,护士在采血时可能过早地拔出针头,导致标本采集过少。在与护理人员的沟通中我们也强调了采血时,需等待真空管负压完全平衡后再拔出针头,避免这种情况发生。
3.标本抽错管
针对标本抽错管这一问题,检验科也与网络中心部门沟通,在条码上醒目显示该检测项目所对应的真空采血管类型,提示护理人员选择正确的真空管采集标本。此外在采血时,护理人员也应该先核对条码上提示的真空管类型,再选择相应的真空管进行采血。
4.条码问题
条码信息若不正确或不完整则无法完成检测,除了条码申请过程中操作错误之外,还可能由于在标本采集后,临床取消检测导致条码中并不存在检测项目的信息。针对这一问题,检验科在标本接收时增加了条码信息不全的提示,如遇此类标本,可尽早与病区护理人员沟通,进一步核实标本是否需要检测。
5.超时送检
标本的及时送检是确保标本质量的重要环节,尤其是对于有采血时间点要求的标本而言更应严格执行,否则将影响检测结果。当临床出具此类检测申请时,我们增加了送检时间要求的提示,再次告知临床医生和采血人员需按时采血并及时送检。
6.重复采血
重复采血将导致2个血液标本上的条码相同,而由于2个标本的采样时间不同,检测结果也可能不同,因而此类标本也在不合格标本范畴。为了解决这一问题所采取的措施是增加医生工作站(HIS)系统的提示。当医生在HIS界面第2次打印相同条码时,HIS就会跳出提示框,提醒医生此条码已打印或标本已采集,询问是否还需再次打印相同的条码。通过增加这一环节的提示,可在一定程度上减少此类不合格标本。
根据不同BD真空采血管类型分析2012年所有血液不合格标本原因。在EDTA-K2抗凝管和柠檬酸钠抗凝管血液标本中,最突出的两大不合格原因为标本凝块和标本量少。其中标本凝块所占比例最大,分别为56.5%和53.7%;其次是标本量少,分别为25.4%和35.2%。而这2个原因在促凝血清管、氟化钠抗凝管和肝素抗凝管的不合格标本中相对较少,分别只占到了11.7%、21.7%和16.6%;6.3%、17.4%和8.3%。对于促凝血清管标本而言,其主要的不合格原因为重复抽血和标本抽错管,所占比例分别为22.7%和21.1%,见表2:
| 表2 不同BD真空采血管标本不合格原因分析(%) |
除之前描述的6大不合格原因之外,血液标本发生溶血会影响检测结果,而造成溶血的主要原因是标本采集和处理方法的问题。采血前应先等待酒精自然风干,否则采血针会将皮肤上残留的酒精带入血液造成溶血。在采血时应避免选择较为细小的静脉,同时避免在静脉中“针头游走”。如果在穿刺时静脉出现损失,则第1支采血管可能出现溶血。所以针对减少溶血标本产生,在对护理人员的宣教工作中也增加了以上几点注意事项。
图1显示,目前不合格血液标本发生的最主要的2大原因依次为标本凝块和标本量少。根据不同BD真空管类型,以EDTA-K2抗凝管发生标本凝块和量少的比例作为对照,分析2012年所有不合格血液标本中发生标本凝块和标本量少的风险。采用Pearson χ2分析数据,柠檬酸钠抗凝管发生标本凝块和标本量少的风险最高,见表3、表4:
| 表3 不同BD真空管标本发生标本凝块的风险比较 |
| 表4 不同BD真空管标本发生标本量少的风险比较 |
表3和表4结果显示,标本凝块和标本量少的情况最多的是发生于柠檬酸钠抗凝管。除了采血人员未及时混匀标本、提前拔出针头之外,使用蝶翼针的采血顺序可能也是造成此类抗凝管血液标本发生凝块和标本量少的因素之一。在实际工作中我们发现,由于在临床护士推广使用的采血顺序是针对直针,第一管血应采集柠檬酸钠抗凝管。但当使用蝶翼针第一管采集柠檬酸钠抗凝管标本时,由于蝶翼针管内有空气死腔,会影响真空管的负压平衡,从而使血液进入真空管的量变少。尤其在采血量本身并不充足的情况下,这一情况可能更为突出。这可能也是标本量少发生于柠檬酸钠抗凝管最多的原因。此外空气中的二氧化碳溶解后改变了抗凝剂的pH值[
分析前质量控制对于检验结果的准确性有着至关重要的作用,需要多环节多部门加强沟通和共同协作。本研究通过了解分析前环节血液标本质量的现状,以及近年来检验科在这方面工作中所做的努力,根据不合格血液标本产生的原因制定相应措施,以及落实后的改善情况。表1结果显示,取得了较好的成果,不合格血液标本率逐年下降,2012年的数据已低于0.50‰。
随着ISO15189质量体系的建立,本科室自2010起成立了检验前质量控制小组,由专人定向负责此项工作。该小组编写了所有检验前程序的质量手册、程序文件、作业指导书以及相关记录,使检验前环节的控制和管理程序化、文件化,并根据实际工作中遇到的问题对文件进行不定期的修订和完善。该小组还负责检验前质量控制的相关培训,如标本接收、不合格标本的定义和退收流程等,使文件能真正指导我们的实际工作。此外该小组负责统计分析科室每月的不合格标本,并根据当月情况及时与临床护士进行沟通,共同分析不合格标本产生原因、制定改进措施、总结注意事项,并在下月观察改善的效果。因此,检验前质量控制小组秉承循环C计划-执行-检查-处理(PDCA)原则,使科室的检验前工作更规范更有效的同时,也很好地起到了与护理部、实验室信息管理人员之间的桥梁作用,推动了标本质量持续改进的循环。
护理人员是确保标本质量的关键环节之一,关系到正确的患者准备、标本采集和运送。每月通过走访病房,与护士长面对面沟通反馈不合格标本情况。每年我们还召开检验科与护理部门间的专题研讨会、发放《临床医学检验手册》和采血注意事项的台卡等,不断提高护理人员对于分析前环节的重视程度。强调了采血前需注意患者准备、核对真空管类型、直针或蝶翼针采血顺序、避免重复采血;采血时需选择合适的静脉、待酒精风干后进针,并等待真空管负压完全充盈;采血后抗凝血标本应及时充分颠倒混匀,标本的及时送检。经检验科与护理部共同协商讨论,护理部将这些注意事项融入到了护理人员的日常培训,同时也是作为新护士采血技能的重点内容进行培训与考核。巩固落实到临床护理人员的日常工作中,从而推动标本质量的不断改进。Romreo[
实验室的信息管理系统(LIS)在分析前环节控制中也起到了非常关键的作用。一方面通过设置可在LIS系统追踪到每一个标本的状态,从医生开具医嘱、标本采集、标本离岸、标本接收等一系列时间均可记录,能有效控制分析前的各个环节。另一方面在标本接收时,检验科LIS系统就可弹出提示框,便于及时发现送检超时、条码无检测项目、重复采血、采样时间不符等标本不合格状态,加快对不合格标本的处理速度,便于临床及时采取相应措施。
总而言之,检验科应建立控制标本质量的制度,及时统计不合格标本情况。加强与临床护理部和LIS管理人员的沟通和配合,共同分析不合格标本产生的原因,并制定相应的对策和措施,推动标本质量的不断提高。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|