朱波,男,1961年生,主任技师,主要从事肿瘤病因、机制及分子诊断研究。
欧超,联系电话:0771-5333422。
所有病例术后进行常规放疗和/或化疗,并追踪随访1年。每月采用电话或信访,术后每隔3个月复查计算机断层扫描,了解有无复发。73例患者中65例有随访资料,其中24例随访6个月出现复发,12例随访1年死亡。
探讨
应用免疫组化法检测73例NSCLC、51例相应的癌旁组织和13例非肿瘤性肺组织的
在73例NSCLC和64例癌旁及非肿瘤组织中,
To investigate the expressions of
The expressions of
In 73 specimens of NSCLC tissues and 64 cases of corresponding adjacent and non-cancerous lung tissues, the positive rates of
The
肺癌是当今世界上对人类健康和生命威胁最大的恶性肿瘤之一。侵袭转移是肺癌患者死亡的首要原因,是1个极其复杂的多基因调控和多步骤发展的过程,并涉及复杂的基因家族群参与的肿瘤转移相关基因的改变,相关基因起抑制肺癌转移或促进转移的作用[
收集2007年8月至2009年6月广西医科大学附属肿瘤医院胸外科手术切除肺癌标本73例(经病理学检查确诊为原发性NSCLC)、相应的癌旁组织[距癌组织>3 cm,经苏木精-伊红(hematoxylin eosin, HE)染色证实无癌细胞浸润]51例和非肿瘤性肺组织标本13例(肺结核5例、支气管扩张4例、炎性假瘤4例)。患者年龄19~78岁,中位年龄56.5岁。腺癌32例(高分化19例、低分化13例),鳞癌41例(高分化19例、中分化16例、低分化6例),依据1997年国际抗癌联盟TNM分期标准,Ⅰ期41例、Ⅱ期19例、Ⅲ期13例。所有患者术前均末接受化疗、放疗及其他抗癌治疗。KAI1抗体购自美国Santa Cruz公司,TIMP-1和MMP-9单克隆抗体购自美国LabVision-NeoMarkers公司,二抗SuperPicTure试剂盒、二氨基联苯胺显色剂均为美国Zymed公司产品。
所有手术标本用10%中性甲醛溶液固定,石蜡包埋,制成厚4 μm的切片,采用免疫组化SuperPicTure法进行KAI1和TIMP-1、MMP-9染色。按SuperPicTure试剂盒操作说明进行,主要步骤如下:切片脱蜡至水,高压修复1.5 min,阻断内源性过氧化物酶20 min,正常非免疫血清封闭30 min,滴加Ⅰ抗在室温孵育1 h,滴加50 μL酶标抗鼠/兔聚合物,室温孵育30 min;新鲜二氨基联苯胺-H2O2溶液显色,苏木精复染。用已知阳性反应片作阳性对照,阴性对照采用磷酸盐缓冲液(phosphate buffered solution,PBS)替代Ⅰ抗进行同步染色。KAI1和TIMP-1、MMP-9工作液浓度分别为1∶150、1∶50、1∶100。
免疫组织化学结果显示肺癌细胞中KAI1蛋白的阳性着色主要表现为细胞浆和/或细胞膜阳性,呈弥漫性分布,TIMP-1蛋白的阳性着色为细胞浆和胞膜内阳性,MMP-9蛋白的阳性着色为细胞膜阳性。染色结果观察采用双盲法,由2位病理科医生在不知病理分级与临床资料的情况下读片,每张切片观察5个视野(400倍)计算阳性细胞数,计算总细胞数不少于1 000个,按阳性细胞所占百分数分为:阳性细胞率<5%为阴性(-);5%~24%为弱阳性(+);25%~50%为阳性(++);>50%为强阳性(+++)。
采用SPSS 16.0软件进行 χ2检验,相关分析采用Pearson法, P<0.05为差异有统计学意义。
所有病例术后进行常规放疗和/或化疗,并追踪随访1年。每月采用电话或信访,术后每隔3个月复查计算机断层扫描,了解有无复发。73例患者中65例有随访资料,其中24例随访6个月出现复发,12例随访1年死亡。
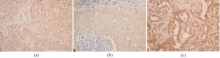
KAI1阳性染色定位于细胞浆和/或细胞膜中,阳性细胞染色呈散在或片状分布,见图1;73例NSCLC中有29例阳性,阳性率为39.7%;在64例癌旁组织及非肿瘤性肺组织中有58例阳性,阳性率为90.6%。两者比较差异有统计学意义( P<0.05)。
TIMP-1蛋白阳性染色定位于细胞浆和细胞膜内,呈弥漫性分布;MMP-9定位于肿瘤细胞核和细胞浆,棕褐色颗粒状或团块状着色,间质的纤维细胞也呈MMP-9 弱阳性,见图1:
注:(a) KAI1阳性染色定位于细胞质或细胞膜;(b)TIMP-1阳性染色定位于细胞浆或细胞膜;(c)MMP-9阳性染色定位于细胞核或细胞质
NSCLC中TIMP-1和MMP-9的阳性率分别为74.0%、79.4%,与相应癌旁组织及非肿瘤性肺组织中阳性率(37.5%、67.1%)相比,TIMP-1在NSCLC的阳性表达率明显高于癌旁组织,差异有统计学意义( P<0.05)。NSCLC标本MMP-9蛋白阳性表达率高于癌旁组织,但差异无统计学意义( P>0.05)。
在29例 KAI1阳性表达的NSCLC组织中18例呈TIMP-1阳性表达,占54例TIMP-1阳性表达的33.3%(18/54);20例呈MMP-9阳性表达,占58例MMP-9阳性表达的34.5%(20/58); KAI1与TIMP-1阳性表达密切相关( r=-0.463 7, P=0.002 2),与MMP-9的阳性表达也密切相关( r=-0.344 5, P=0.027 3),呈负相关。
73例NSCLC患者按年龄、性别、肿瘤类型及分化程度、TNM分期、淋巴结转移分组。 KAI1和TIMP-1、MMP-9在NSCLC组织中的检出率与TNM分期、淋巴结转移明显相关( P<0.05),与年龄、性别无关; KAI1的检出率与肿瘤类型也明显相关( P<0.05),而TIMP-1和 MMP-9的检出率与肿瘤类型无明显关系。见表1:
| 表1 KAI1和TIMP-1、MMP-9在NSCLC中阳性率与临床生物学行为的关系[例(%)] |
肺癌是目前对人类健康与生命威胁最大的恶性肿瘤之一,近半个世纪以来其发病率和死亡率均呈上升趋势。影响肺癌患者疗效和导致死亡的最主要原因是肺癌的侵袭与转移[
本研究发现 KAI1的检出率与肿瘤类型明显相关( P<0.05),而TIMP-1和 MMP-9的检出率与肿瘤类型无明显关系,进一步的研究发现 KAI1与TIMP-1、MMP-9在NSCLC表达密切相关(负相关),这与Jee等[
总之, KAI1在NSCLC中低表达,相反TIMP-1、MMP-9在NSCLC中高表达,三者不同程度地与淋巴结转移、TNM分期、肿瘤类型有关, KAI1与TIMP-1、MMP-9之间存在负相关关系,提示 KAI1可能通过上调TIMP-1、MMP-9的表达促进肺癌的发展。说明三者与肺癌的发展有关,可成为评价预后的参考指标,联合检测三者对判断肺癌的组织分化、恶性程度有指导意义。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|