蒋玲丽,女,1980年生,硕士,主管技师,主要从事免疫学和分子生物学的质量控制工作。
探讨利用质控数据评定荧光定量聚合酶链反应(PCR)测定HBV DNA测量不确定度的可行性。
方法用批内不精密度和批间不精密度数据评定A类不确定度;分别用参加卫生部临床检验中心和美国病理学家协会(CAP)的室间质评数据评定B类不确定度;最后评定合成不确定度和扩展不确定度。
结果利用卫生部临床检验中心室间质评反馈结果评定的扩展不确定度(
目前用室间质评数据评定PCR测定HBV DNA的不确定度不能真实反映实验室的不确定度,使用国家标准物质评定不确定度更合适。
To investigate the uncertainty of hepatitis B virus (HBV) DNA determination by fluorescence quantitative polymerase chain reaction (PCR) according to quality control data, and evaluate the feasibility.
MethodsThe uncertainty of Type A was evaluated by the data of within-run and between-run coefficients of variation. The uncertainty of Type B was evaluated according to the data of external quality assessments from the National Center for Clinical Laboratory and College of American Pathologists(CAP). The combined uncertainties and expanded uncertainties were evaluated and analyzed.
ResultsThe expanded uncertainties in 104-105 IU/mL and 106-107 IU/mL concentrations were 0.521 6 and 0.529 8(
It is not bilievable to evaluate the uncertainty of HBV DNA determination by fluorescence quantitative PCR, and it is suitable to evaluate the uncertainty using the results traced back to the national standard substance.
实时荧光定量聚合酶链反应(polymerase chain reaction,PCR)是目前国内乙型肝炎病毒(HBV)检测应用最广泛的方法。临床对HBV患者体内病毒复制水平或临床抗病毒治疗效果判断普遍凭借临床经验, HBV DNA降低12个数量级被认为抗病毒治疗有效,但这种经验方法缺乏实验数据支撑,1个可靠的检测结果还必须依赖不确定度为临床提供准确的参考[
1. 检测仪器
瑞士Roche公司的lightcycler实时荧光定量检测仪、杭州博日HB-100型恒温金属浴、德国Biofuge-Fresc O高速冷冻离心机。
2. 检测试剂
上海科华生物工程股份有限公司生产,批号20111212。严格按照试剂说明书操作。
3. 样品
取2例临床确诊乙型肝炎患者血清,用于批内重复性实验。取上海市地区性室内质控品2个浓度,批号1201,用于批间重复性实验。
1. 测量不确定度的评定程序
利用实验室提供的方法学性能验证数据评定A类不确定度,分别用参加卫生部临床检验中心和美国病理学家协会(CAP)组织的HBV DNA室间质评数据评定B类不确定度;本研究中所有不确定度分量全部采用标准不确定度(即标准差)表示;分别评定测量观测值个数 n=1、2、3 3种情况下的合成不确定度和扩展不确定度。
2. 不确定度A类评定
实验室可提供的方法性能参数包括批内重复性和批间重复性。(1)批内重复性分析:以不同浓度水平的2例乙型肝炎患者血清标本,重复检测20次,计算2个浓度水平的批内标准差[ s(w)];由批内重复性引起的不确定度u(w)=[ s(w)]/ 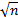
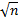
3. 不确定度B类评定
室间质量评价活动。根据本室参加2012年卫生部临床检验中心和CAP HBV DNA室间质评结果,统计每个结果与靶值的差值(dn),计算差值的平均值(dm)及其标准差( sdr),u(bias)= 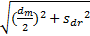
4. 合成不确定度和扩展不确定度的评定
根据公式确定合成不确定度(uc),uc= 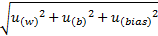
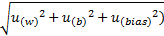
5. 每次实验均做室内质控,当质控结果在控时,实验数据才能采用,否则,应重新进行检测。
所有统计均将初始浓度值QDNA进行对数转化为LGQ后计算。统计结果小数点后保留4位有效数字。
一、PCR测定HBV DNA 2种浓度水平,计算由批内重复性和批间重复性导致的不确定度分量见表1:
| 表1 批内和批间重复性引起的不确定度分量 |
二、PCR测定HBV DNA,通过2012年参加的卫生部和CAP反馈的室间数据,计算由方法偏倚因素引起的不确定度结果见表2:
| 表2 方法偏倚不确定度 |
三、PCR测定HBV DNA合成不确定度与扩展不确定度评定。见表3和表4:
| 表3 合成不确定度与扩展不确定度(卫生部室间数据评定) |
| 表4 合成不确定度与扩展不确定度(CAP室间数据评定) |
由7个国际著名学术组织颁布的在计量学上有深远影响的标准“测量不确定度表示导则(Guide to the Expression of Uncertainty in Measurement, 简称GUM)”,对测量不确定度评定与表示的一般规则作出了规定和说明[
目前国内PCR测定主要依靠手工进行核酸提取,整个操作步骤繁多。有国内学者指出PCR测定HBV DNA的不确定度来源包括:模板制备过程中的标本浓缩和核酸提取来源的不确定度、扩增反应体系来源的不确定度、数据处理的不确定度、相关仪器设备(如热循环仪和移液器等)的不确定度[
另外,本实验室同时参加了卫生部临床检验中心和CAP组织的室间质评,通过室间质评数据评定B类不确定度,以此来估计由方法偏倚(系统效应)导致的不确定度。由于室间质评的频次和数据较少,在评定B类不确定度时,我们未按检测样品浓度分组统计。2012年卫生部临床检验中心共组织2次室间质评,通过7个阳性标本计算得到的方法偏倚导致的B类不确定度为0.099 7;2012年CAP组织3次室间质评,通过5个阳性标本计算得到的方法偏倚导致的B类不确定度为0.430 8;通过2个不同机构组织的室间质评数据评定B类不确定度数据差异较大。从表3和表4可以看出,当HBV DNA的检测浓度在104105和106107IU/mL, n=1, k=1.96时,通过卫生部室间质评数据计算,其扩展不确定度分别为0.521 6和0.529 8;通过CAP室间质评数据计算,其扩展不确定度分别为0.973 1和0.977 5。同一实验室,通过不同机构的室间数据来源评定B类不确定度,其得出的扩展不确定度竟相差0.451 50.447 7。主要原因在于:2个机构对HBV DNA项目的评价方式不同,CAP组织HBV DNA室间质评项目以方法组的均值作为靶值;卫生部临检中心采用溯源至国家标准品得出的检测值作为靶值,并不对检测试剂进行分组,而不同品牌试剂检测结果存在较大差异。由此可见,虽然采用“经验办法”评定PCR测定HBV DNA的不确定度简便易行,但采用室间质评数据评定不能反映实验室真实的测量不确定度。如果使用HBV DNA国家标准物质评定B类不确定度,可避免由于评价方式的不同造成的B类不确定度的差异。在日常检验工作中应用标准物质,将极大的改善不同实验室间检验结果的可比性,从而逐步实现不同实验室间检验结果有条件的互认[
综上所述,“经验办法”评定PCR测定HBV DNA的不确定度虽然简便易行,但利用室间质评数据评定,由于其评价方式不同不能准确真实地反映实验室不确定度。可以进一步探讨采用检测国家标准物质数据评定PCR测定HBV DNA的不确定度。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|

