徐蕾,女,1972年生,硕士,副主任医师,主要研究方向为心血管病的发生机制与干预策略。
杨奕清,联系电话:021-62821990。
分析先天性二叶式主动脉瓣畸形(BAV)相关
收集150例先天性BAV患者和200名健康对照者的临床资料和血标本,使用DNA纯化试剂盒抽提基因组DNA。通过聚合酶链反应扩增
在2例先天性BAV患者各发现1个新的GATA5基因杂合突变,即p.M219I和p.T289I,突变率约为1.33%。这2种突变均不存在于200名健康对照者中。多序列比对显示被改变氨基酸在进化上均完全保守,致病性预测表明这2种突变均具有致病性。
结论发现BAV相关
To analyze the mutational spectrum of
A total of 150 patients with congenital BAV and a total of 200 healthy subjects as controls were enrolled. The clinical data were collected, and the peripheral venous blood specimens were prepared. The genomic DNA was isolated by DNA purification kit. The coding regions and splice junction sites of
Two novel heterozygous
This study links novel
先天性二叶式主动脉瓣畸形(bicuspid aortic valve,BAV)是人类最常见的先天性心脏病,其在一般人群中的发病率约为0.5%~2.0%,男性发病率较女性高,男女之比约为3∶1[
选取2011年1月至2013年6月上海交通大学附属胸科医院就诊、无血缘关系的先天性BAV患者150例,其中男81例,女69例,年龄32~65岁;另同期选取200名无血缘关系的健康对照者作为正常对照组,其中男106名,女94名,年龄30~62岁。所有对象均为中国汉族人,均知情同意。临床评估包括详细病史、全面体检以及心脏超声和心电图检查。
1.标本采集
所有对象均采集外周静脉血3 mL,置于含有0.5 mL抗凝剂(枸橼酸、枸橼酸钠、葡萄糖混合液)的试管中,混匀后-80 ℃冰箱冻存备用。
2.基因组DNA的抽提
使用基因组DNA(genomic DNA,gDNA)抽提试剂盒(美国Promega公司),按照操作说明书自全部研究对象的外周静脉血标本抽提gDNA。
3.扩增 GATA5基因编码区和剪接点的引物设计及合成
根据GenBank数据库中 GATA5基因的gDNA序列(登陆号:NT_011362),利用Primer 3.0软件计算机辅助在线设计6对引物以扩增 GATA5基因的6个编码外显子(外显子27)及其2侧的部分内含子。引物序列见表1[
| 表1 扩增GATA5基因编码外显子和剪接点的引物序列 |
引物均由上海生工生物工程公司合成。
4. GATA5基因目的片段的扩增
以研究对象的gDNA为模板,采用HotStar Taq DNA聚合酶等聚合酶链反应(polymerase chain reaction,PCR)试剂(德国Qiagen公司),分别使用上述6对引物在ABI PE9700热循环仪(美国ABI公司)上通过PCR扩增目的基因片段。使用QIAquick凝胶回收试剂盒(德国Qiagen公司)纯化扩增产物。
5. GATA5基因目的DNA片段的测序
使用Big Dye Terminator v3.1循环测序试剂盒(美国ABI公司)在ABI PRISM 3130 XL 型DNA分析仪(美国ABI公司)上对每一纯化的PCR产物进行测序。测序引物同上述用于特定区域扩增的引物。使用5.1版本DNA测序分析软件(美国ABI公司)分析测序结果并将所测序列与GenBank中的已知 GATA5序列(登陆号:NM_080473)进行比对以识别基因变异。对于所识别的基因变异,检索PubMed和SNP数据库(http://www.ncbi.nlm.nih.gov)以及万方数据库(http://www.wanfangdata.com.cn)以明确是否已有报道。
6.多物种GATA5蛋白序列比对分析
采用在线分析程序MUSCLE V3.6(http://www.ncbi.nlm.nih.gov)对比分析多物种GATA5蛋白氨基酸序列。
7. GATA5突变的致病性预测
使用在线程序MutationTaster(http://www.mutationtaster.org)预测所识别的 GATA5突变的致病性,并给出正确预测的概率值(该值越接近1表示预测的正确性越高)。
采用SPSS 15.0软件进行统计分析。连续变量用 ±s表示且进行正态分布检验。使用非配对Student’s t检验对2组数值变量进行比较。2组分类变量的比较使用Pearson’s χ2 检验或Fisher’s精确概率计算。 P<0.05为差异有统计学意义。
临床评估发现BAV组均无明显的BAV传统危险因素,如母亲孕期服用药物、病毒感染以及接触毒物或放射线照射等。通过测序分析发现150例BAV患者中有2例患者发现了2种 GATA5杂合错义突变,突变率约为1.33%;在正常对照组中均未发现这2种 GATA5基因突变。经检索PubMed数据库、SNP数据库以及万方数据库,这2种 GATA5基因突变均无报道,提示为新突变。
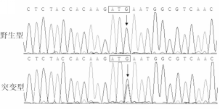
具体而言,在1例57岁男性散发性BAV患者中,其 GATA5基因编码核苷酸序列第657位的鸟嘌呤(guanine,G)变为胞嘧啶(cytosine,C),即c.657G>C突变,导致 GATA5基因编码氨基酸序列第219位的蛋氨酸(methionine,M)变为异亮氨酸(isoleucine,I),即p.M219I突变。 GATA5基因c.657G>C突变及其对照序列见图1:
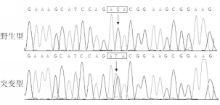
在另1例46岁女性散发性BAV患者中,其 GATA5基因编码核苷酸序列第866位的C变为胸腺嘧啶(thymine,T),即c.866C>T突变,导致 GATA5基因编码氨基酸序列第289位的苏氨酸(threonine,T)变为I,即p.T289I突变。 GATA5基因c.866C>T突变及其对照序列见图2:
注:箭头所指分别为GATA5基因野生型纯合子C/C和突变型杂合子C/T序列
GATA5蛋白质结构与显示BAV相关基因突变的示意图见图3:
注:TAD为转录激活域;ZF为锌指;NLS为核定位信号
经MutationTaster预测,所识别的GATA5基因变异c.657G>C和c.866C>T均为致病性突变,预测正确的概率值分别为0.999 999 991 295 232和0.999 999 996 908 734。在MutationTaster数据库中,没有报道本研究所发现的GATA5基因变异,进一步表明这些 GATA5基因变异是新突变。
本研究在2例无血缘关系的家族史阴性的BAV患者发现了2种新的GATA5基因突变p.M219I和p.T289I,这些突变不存在于200名无血缘关系的健康对照者中。多物种GATA5蛋白序列比对显示被改变的氨基酸在进化上完全保守,计算机功能模拟分析提示这些突变具有致病性。因此, GATA5基因突变很可能是这2例BAV患者发病的分子病因,但确切的致病机制和致病性的大小仍有待于研究。
人类 GATA5基因定位于20q13.33,编码一种由397个氨基酸组成的转录因子,在心脏发育期间调节多个靶基因的表达,包括心房利钠肽、α-肌凝蛋白重链、β-肌凝蛋白重链、心肌肌钙蛋白C和心肌肌钙蛋白I[
GATA5基因缺陷对心血管畸形的诱导作用已经被一些动物实验证实。在斑马鱼中, GATA5基因敲除可因心内膜和心肌分化迁移障碍而导致胚胎死亡[
GATA5基因变异与人类BAV的关系以前也有报道。Padang等[
总之,本研究发现了BAV相关 GATA5基因新突变,揭示了BAV新的分子病因,这不仅有助于揭示BAV新的分子机制,也有助于BAV患者的危险分层、早期预防和个体化治疗。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|