吕晓楠,女,1987年生,硕士,主要研究方向为分子诊断。
曾骥孟,联系电话:0592-2187226。
建立多重逆转录-聚合酶链反应(RT-PCR)联合毛细管电泳法检测
采用重叠延伸法构建
多重RT-PCR技术检测
成功建立检测
To establish a method for detecting
The construction of
The lower detection limit for
The method of multiplex RT-PCR combining with capillary electrophoresis to detect
慢性粒细胞白血病(chronic myeloid leukemia,CML)是第一个将染色体异常与特定的肿瘤类型联系在一起的恶性血液性疾病,占成人白血病的15%,在我国年发病率为0.36/10万人[
目前融合基因的检测方法主要有染色体核型分析、荧光原位杂交(fluorescence in situ hybridization,FISH)以及逆转录聚合酶链反应(reverse transcription PCR,RT-PCR)等。染色体核型分析虽是临床上常规检测手段,但对样本和技术要求高,检测灵敏度低,尤其对于微小染色体易位难以检测出,故临床上通常还需要分子生物学等手段来进一步验证[
血液样本均来源于厦门大学附属中山医院,其中融合基因阳性模板构建样本来自体检中心健康体检者,研究病例来自血液科2010年至2013年住院的CML患者50例,男34例,女16例,年龄1585岁,全部病例经过临床血象、骨髓象等形态学检测初步确诊,且均进行了染色体核型分析,诊断标准参照血液病诊断及疗效标准,具体见表1[
| 表1 CML的诊断标准 |
正常对照组为18名健康体检者,男10名,女8名,年龄1870岁。
1. 血液样本RNA提取和cDNA模板第一链合成
CML患者及体检者外周抗凝全血5mL,采集后尽快进行RNA抽提,以防时间过长或反复冻融后损坏RNA的品质。设备为MagCoreHF16全自动核酸抽提仪及其配套全血RNA抽提试剂盒(厦门芮宝生医股份公司),操作严格按仪器和试剂盒说明书;并用TransScript cDNA第一链合成试剂盒(北京全式金公司)进行反转录后,将cDNA模板分装,置于-20℃保存备用。
2. BCR-ABL融合基因阳性模板构建
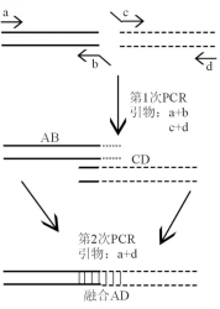
采用重叠延伸PCR法[
3. 引物设计
BCR基因以其在NCBI中的登录号NM_004327上的mRNA序列为准, ABL基因则以文献中常见的登录号X16416上的mRNA序列为准。扩增所需引物(表2、表3)的设计均通过软件Primer Premier v 5.00进行,并经 BLAST 比对确认其特异性。设计好的引物由上海生工合成,回来后进行稀释,分装成多管保存在-20℃,避免反复冻融。
| 表2 构建阳性模板的引物设计 |
| 表3 检测融合基因的多重引物设计 |
4. 多重RT-PCR联合毛细管电泳检测体系的建立与优化
初始反应体系:10×PCR缓冲液2.5 μL,2.5 mmol Mg2+ 2 μL,2.5 mmol dNTPs 2 μL,10 μmol/L上、下游引物各0.5 μL,5 U/μL TaqDNA聚合酶0.4 μL,cDNA模板5 μL,加双蒸水,补足反应总体积为25 μL。PCR扩增条件:95 ℃ 1 min;95 ℃ 30 s,6661℃ 30 s(每个循环降低1℃),72 ℃ 20 s,5个循环;95 ℃ 30 s,61 ℃ 30 s,72 ℃ 20 s, 25个循环。影响多重RT-PCR反应的因素很多[
5. 多重RT-PCR联合毛细管电泳检测体系的性能评估
(1)灵敏度分析:将构建的阳性模板(e1a2、e13a2和e14a2)质粒均进行10倍梯度稀释,即稀释成100107拷贝/μL 8个浓度梯度,在优化的PCR条件下进行反应,分析该方法最低检测拷贝。每个浓度梯度作2个平行反应,每次实验均设置1个阴性对照(以灭菌超纯水为模板);(2)特异性分析:检测18名健康体检者外周血融合基因,观察此方法的特异性;(3)模拟分析:将构建成功的BCR-ABL融合模板( e1 a2、 e13 a2、 e14 a2,105拷贝/μL)分别与正常人血液cDNA(50 ng/μL)进行混合,模拟自建方法检测临床阳性样本的情况。
6. 多重RT-PCR体系检测临床样本的 BCR-ABL 融合基因
用自建的多重RT-PCR结合毛细管电泳技术平行检测50例CML患者患者。
采用SPSS 13.0软件进行统计分析。采用McNemar检验和一致性检验分析,评价建立的多重RT-PCR法的阳性率以及与荧光定量PCR法结果总符合率。 P<0.05为差异有统计学意义。
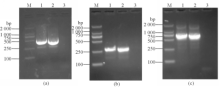
通过重叠延伸法,第1次PCR分别得到扩增产物BCR-1/2/3(468/142/217 bp)和ABL-1/2/3(291/295/297 bp),第2次融合扩增PCR反应得到 BCR-ABL基因的3种融合形式,即 e1 a2(724bp), e13 a2(398bp), e14 a2(473bp)。2%琼脂糖凝胶电泳检测,结果见图1、2。以超纯水作为阴性对照。
注:(a)BCR-1(468 bp);(b)ABL-1(291 bp);(c)由a和b 2个基因片段融合形成 e1 a2(724 bp);M为Marker(DL2000,Takara),图上方数字表示泳道,每个目的片段做2个平行,3为阴性对照
注:(a)扩增的2个不同大小的BCR-2/3(142/217 bp);(b)扩增的2个不同大小产物ABL-2/3(295/297 bp);(c)由a和b 2个基因片段融合形成 e13 a2(398 bp)和 e14 a2(473 bp);M为Marker(DL2000,Takara),图上方数字表示泳道,每个目的片段做2个平行,3、7为阴性对照
分别设置的1.02.5 U的酶用量梯度以及0.080.2 μmol/L的引物浓度梯度结果显示 BCR-ABL融合基因PCR体系中最佳酶和引物用量分别为0.2 μL和0.3 μL。因此,建立的多重RT-PCR最佳反应体系为:10 PCR缓冲液2.5 μL,2.5 mmol Mg2+ 2 μL,2.5 mmol dNTPs 2 μL,10 μmol/L上下游共3条引物各0.3 μL,5 U/μL TaqDNA聚合酶0.2 μL,构建的阳性模板cDNA 5 μL,加双蒸水,补足反应总体积为25 μL。PCR扩增产物分别进行毛细管电泳结果与2%琼脂糖电泳,电泳结果一致,但毛细管电泳能够准确的计算出产物长度,进样量少,操作自动化,方便临床大批量样本快速、准确、直观的检测。
1. 灵敏度分析
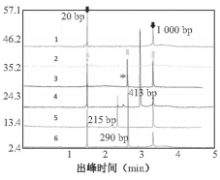
将 e1 a2、 e13 a2和 e14 a2 3种模板以10倍梯度稀释,系列稀释样本检测结果见图3:
注:(a)、(b)、(c)分别表示 e1 a2(413 bp)、 e13 a2(215 bp)、 e14 a2(290 bp)3种模板不同浓度梯度的色谱图;向下箭头表示Marker(20 bp、1 000 bp);向上箭头表示目的片段;图中数字18表示3种质粒模板量以107100 拷贝/μL梯度稀释结果;9表示空白对照
e1 a2本法的最低检测限为102拷贝/μL, e13 a2和 e14 a2均为103拷贝/μL。
2. 特异性分析
18名健康体检者外周血标本中均未检测到 BCR-ABL融合基因,表明本法具有良好的特异性。
3. 模拟分析
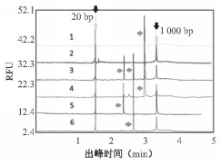
阳性模板与正常人血液混合后的模拟样本检测结果如图4,36号混合标本电泳出现的条带与预期一致,正常血液无阳性电泳结果。
注:向下箭头表示Marker(20 bp,1 000 bp);向上箭头表示扩增片段;图中数字4、5、6分别表示和正常血液cDNA混合下的 e1 a2(413bp)、 e13 a2(215bp)、 e14 a2(290bp)模板扩增;3表示在正常血液环境下的3种融合形式共混合扩增;2表示正常血液cDNA扩增(阴性对照);1表示空白对照
应用自建的多重RT-PCR联合毛细管电泳方法对50例CML的患者外周血进行融合基因检测, BCR-ABL融合基因阳性率为86.0%(43/50),其中 e13 a2型20.0%、 e14 a2型66.0%,阳性率较低与本组病例中包括6例复诊者有关。与骨髓细胞培养染色体核型分析比较,本方法检测 BCR-ABL融合基因的阳性符合率为97.6%(41/42),阴性符合率为75.0%(6/8),总符合率为94.0%(47/50),2种方法具有较高的一致性( Kappa=0.765, P>0.05)(表4):
| 表4 2种方法检测 BCR-ABL融合基因结果比较 |
以1例CML患者为例,其检测结果见图5:
注:向下箭头表示Marker(20 bp、1 000 bp);向上箭头表示目的片段;图中数字1表示以超纯水为模板(空白对照);2表示正常人血液cDNA扩增结果(阴性对照);3表示患者血液cDNA模板扩增结果;4、5、6表示 e1 a2(413 bp)、 e13 a2(215 bp)、 e14 a2(290 bp)阳性模板扩增(阳性对照)
患者的电泳结果与 e14 a2阳性对照模板处于一个位置,即表示此CML患者存在 BCR-ABL融合基因的 e14 a2融合形式。检测中以正常血液为阴性对照,确保此方法特异性;以构建的阳性模板为阳性对照;以超纯水做模板为空白对照,以排除试剂污染。
目前,临床实验室进行白血病诊断分型需要联合通过形态学(morphology,M)、免疫学(immunology,I)、细胞遗传学(cytogenetics,C)和分子生物学(molecular biology,M)检查,即MICM 分型系统。就CML而言,由于超过95%患者具有费城染色体,故细胞遗传学方法如核型分析即为初始判断CML的常规手段。然而,这个方法样本要求高,灵敏度低(一般在5%以上),无法检测到细微的染色体易位(约占所有患者的5%)[
早期检测融合基因的PCR法常将多重PCR与巢式PCR结合,该类方法灵敏度(10-410-5)高,在微小残留性疾病的监测上具有重要意义[
费城染色体的形成即是位于9号染色体上q34区的 ABL基因3端断裂片段连接到22号染色体上q11区的 BCR基因5端断裂处,融合形成新型基因 BCR-ABL。 BCR和 ABL基因断裂点并不止一种,故会产生不同的融合形式,最常见的就是 ABL基因内含子1和 BCR基因内含子1、13或者14位置断裂后融合形成的转录子 e1 a2、 e13 a2或 e14 a2。其中 e1 a2编码190-kD蛋白P190, e13 a2和 e14 a2编码1种210-kD蛋白,即P210,这2种融合形式在CML细胞中以1种存在或共存(5%)[
它的特点就是在2条基因连接处的引物设计中添加了能够与对方基因互补配对的碱基序列尾巴,从而通过碱基互补配对原则将两条基因连接起来,且连接处无添加额外碱基。所以构建融合基因模板的引物设计尤为重要,根据这3种融合形式( e1 a2、 e13 a2和 e14 a2)具体的融合点,才能获得准确的融合模板。根据本研究的方案,可设计出各种可能融合模式的检测方法,用于CML分子发病机制研究。
本法在CML诊断分型、药物选择上具有实际应用价值,但在微小残留性疾病监测上还有待进一步研究。课题组正不断搜集各类、各期CML样本,包括典型和非典型的,初/复诊、复发型等。在后续工作中,将以所构建的各融合基因( e1 a2、 e13 a2、 e14 a2)模板稳定转染到阴性HL-60细胞系中,与正常血液混合后采用本方法定性、定量检测每mL血液中的异常细胞数,为本方法在微小残留性疾病的分析和检测监测上提供进一步的性能评价。此外,费城染色体虽是CML的标志,存在于95%以上的CML患者中,但在急性淋巴细胞白血病(acute lymphoblastic leukemia,ALL),急性髓性细胞白血病(acute myeloid leukemia,AML)患者中也有显著的发生率。其中 e1 a2主要存在于70% Ph+ ALL以及少数CML、AML细胞中[
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|