华法林是临床广泛使用的口服抗凝药物。由于自身狭窄的有效抗凝治疗范围以及个体间每日用药剂量的显著差异,困扰着许多患者和临床医生。近年来,许多研究均报道基因多态性是引起华法林个体间用药剂量差异的主要因素之一。部分学者建立基于药物基因组学的剂量方程,并在进行验证,评估其临床价值。本文综述了华法林相关药物基因组学的国内外最新进展,为进一步针对华法林的临床研究提供参考依据。
Warfarin, a commonly prescribed anticoagulant, has warried lots of patients and doctors because of its narrow therapeutic range and large interindividual variability in daily dose. During recent years, many studies focus on genetic polymorphisms, regarding it as one of the main effects which lead to dose difference between individuals. Some of them established and verified pharmacogenetic-based warfarin-dosing algorithms and evaluated the clinical significance. Our review exhibits the latest development of warfarin-related pharmacogenomics home and abroad, in order to provide references for further clinical studies.
华法林是用于防治静脉和动脉血栓栓塞性疾病使用最为广泛的抗凝药物,主要适用于心脏瓣膜置换、房颤、深静脉血栓和肺栓塞患者。华法林是一种消旋混合物,由两种具有光学活性的同分异构体R型和S型等比例构成[
R-华法林的代谢主要是由细胞色素P450酶家族中的酶3A4、1A2和1A1完成。同工酶3A4可以代谢R-华法林,催化其成为无活性形式的10-羟基华法林。由于肝源性的细胞色素P450酶中,同工酶3A4占有很高的比例因此被认为是与R-华法林异构体代谢主要相关的酶类。S-华法林代谢主要是由细胞色素P450酶家族中的酶2C9完成,它可以代谢约80%85%的S-华法林,催化其成为无活性形式6-羟基或7-羟基华法林。约有45%的华法林最后代谢成为7-羟基华法林,参与该代谢途径的细胞色素酶仅有细胞色素P450酶2C9(CYP2C9)[
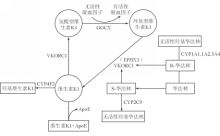
多项研究表明,华法林相关基因的单核甘酸多态性(SNPs)与个体所需华法林剂量有关,并与华法林使用过程中抗凝不足或者出血等副作用的发生相关。华法林药物基因主要可以分为两类,首先是与华法林作用代谢和作用靶点相关的基因,如 CYP2 C9和 VKORC1等;其次是与体内维生素K1代谢循环相关的基因,如 GGCX、 CYP4 F2、 EPHX1、 APOE等。上述酶类在华法林代谢和维生素K循环的作用见图1:
CYP2 C9是编码细胞色素P450酶2C9的基因,位于染色体10q24.2,全长55kb,由9个外显子组成。由于 CYP2 C9编码的酶2C9主要负责代谢华法林, CYP2 C9基因突变可引起代谢华法林能力降低,降低所需的华法林使用剂量。目前报道最多的SNPs是野生型 CYP2 C9*1,突变型 CYP2 C9*2(rs1799853)和 CYP2 C9*3(rs1057910)。Lindh等[
VKORC1是编码维生素K环氧化物还原酶复合体1的基因,位于染色体16p11.2,全长11Kb。VKORC1作为维生素K代谢循环中的限速酶,是华法林在体内作用的靶点,其编码基因 VKORC1的多态性会引起人体对于华法林的抵抗。Yang等[
CYP4 F2是编码细胞色素P450家族酶4F2的基因。细胞色素P450酶CYP4F2是一种氧化酶,主要负责代谢体内维生素K1。其代谢产物为含有羟基的维生素K1。Matthew G. McDonald等[
γ-谷氨酰基羧化酶是由 GGCX基因所编码的一种定位于粗面内质网和高尔基体上完整的微粒体膜酶,可使维生素K依赖性的凝血因子Ⅱ、Ⅶ、Ⅸ、Ⅹ以及蛋白C、S、Z上的γ-谷氨酸残基发生羧化,成为有活性的凝血因子参与凝血功能。当γ-谷氨酰基羧化酶的活性发生变化,会直接引起凝血因子活化异常,最终导致所需华法林的剂量升高。主要报道的SNPs位点是 GGCX 3261 G>A(rs12714145)和rs699664 (p.R325Q)。Huang等[
微粒体环氧化物水解酶,是维生素K环氧化物还原酶的另一个亚单位,由 EPHX1基因编码。文献报道该类酶具有维生素K环氧化物的1个结合位点。Wadelius等[
| 表1 中国汉族人群华法林相关基因SNPs分布情况 |
临床上对于华法林基因多态性检测的要求除了检测结果的准确性之外,TAT和检测费用是非常重要的2个方面。对于临床实验室,选用的基因多态性检测方法决定了检测仪器、试剂和耗材的选用,最终直接和上述标本周转时间(TAT)和检测费用相关。目前国内外对于华法林基因多态性检测的位点主要有 CYP2 C9*2(rs1799853)、 CYP2 C9*3(rs1057910)、 VKORC1 1173(rs9934438)和 VKORC1 1639(rs9923231)。常规使用的检测方法包括有直接测序法、高分辨熔解曲线(HRM)[
传统的经验化给药方式的弊端在于需要多次检测INR,并根据结果改变相应的华法林剂量,以至于长时间无法达到治疗窗或易发生出血事件。因此美国国家食品和药品监管局(FDA)先在2007年在华法林药品处方信息上添加了基因对于药物疗效的影响,之后于2010年修订华法林的药物处方信息,将基因对于华法林药效的影响纳入到考虑范围内,提出医师可以为患者提供基因检测的机会,并提供了基于 VKORC1和 CYP2 C9 2个基因的华法林剂量表格。上述措施均旨在强调基因对于华法林药效的影响。近年来,许多研究团队通过将基因型连同其它相关影响因素一起,建立了基于药物基因组学的华法林剂量公式,并且以不同的方式包括前瞻性的随机抽样验证和回顾性的验证,就剂量公式的临床价值进行了评估[
2005年Sconce等[
上述针对华法林初期治疗的前瞻性研究中,所给初始剂量都是基于维持剂量公式而计算得出的,而华法林用药过程中,出血或者抗凝不足等不良事件往往发生在用药初期,对于临床而言初始剂量尤为重要。2011年Gong等[
基于药物基因学的剂量公式的建立,主要囊括了 VKORC1, CYP2 C9 2个基因的多态性位点和其他相关因素。但是由于许多其他基因如 CYP4 F2、 EPHX1、 GGCX等基因的多态性同样会影响个体间华法林剂量的差异,因此也有许多研究将以上基因一同纳入到剂量公式中,旨在更好地估计华法林剂量。Gu等[
虽然华法林基因剂量方程的研究取得了不小的进展,但对于其临床应用依然存在争议。部分学者对于将华法林药物基因学研究的临床价值持乐观态度。他们认为虽然使用之前纳入年龄、体重、患病史、药物和食物的影响的剂量方程可以缩短患者服药后达到有效治疗范围(INR值控制在1.83.0之间)的时间[
但是有待解决的问题还是存在的,首先是如今的华法林剂量公式只能解释50%高加索人种的个体用药差异,对于亚洲和非洲人群,其所能解释的程度要低很多,因此剂量公式中也许需要纳入新的影响因素。另外,如何将建立的维持剂量公式作为初始剂量公式进行使用仍旧没有定论,许多前瞻性研究均直接以维持剂量公式计算的结果作为初始给药的剂量,其可行性尚未得到论证。最后要推广以华法林药物基因学为指导的给药方式,需要更大规模的临床实验去验证其可靠性。无论是支持用药前进行基因多态性检测的学者还是反对的学者均一致认为在初始阶段基于药物基因学的华法林剂量公式对于防范出血或者血栓形成发生的临床价值有待更多随机、大样本、多种族的前瞻性研究去论证[
总之,在诸多耐药相关基因中,华法林相关基因是研究较为多的1项,最有望成为个体化治疗的切入点。但目前研究多以高加索人群为主,国内研究也多以维持剂量的回顾性研究较多,涉及基因不全面,没有涵盖初始及维持剂量的基因—剂量方程及前瞻性验证。仍需进一步的研究,更有效、安全地为中国服用华法林的患者合理使用华法林提供帮助。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|
| [34] |
|