慢性肾脏病( chronic kidney disease, CKD)是世界范围的公共卫生问题,中国人群CKD发病率为10.8%,上海CKD的发病率高达11.8%,所以CKD更是中国面临的公共健康问题[ 1, 2]。肾脏疾病的正确诊断以及治疗很大程度上依赖于血清肌酐 (creatinine,Cr)的准确测定。血清尿素(urea,UN)水平是临床评价肾功能和蛋白代谢的一项重要指标。大量流行病学调查表明高尿酸(uric acid,UA)血症是心脑血管疾病的危险因子,是肾损害的起动因子[ 3, 4, 5]。因此,Cr、UA、UN的准确测定具有重要的临床意义。
室间质量评价(external quality assessment,EQA)是由实验室以外的某个机构对各实验室常规工作的质量进行监测和评定,以评价各实验室工作质量,逐步提高常规检测的准确性和可比性。本研究主要对上海市临床实验室2012年度EQA血清Cr、UA、UN检测的结果进行分析,了解上海地区Cr、UA、UN检测的现状,为这些项目的标准化进程提供实验数据。
EQA质评物为英国朗道公司人源基质质控品,质控品按说明书要求复溶。复溶完全后,同水平质控品混合后分装,编号分别为RC2012101、RC2012102、RC2012103、RC2012104、RC2012105;RC2012201、RC2012202、RC2012203、RC2012204、RC2012205。
2012年度2次EQA参加单位分别为508、506家,其中二、三级医院2次均为171家,一级医院第1次111家,第2次110家,乡卫生院第1次95家,第2次94家,民办医院2次均为104家,独立实验室2次均为10家,其他2次均为17家。
所有EQA样本分发前都按能力验证提供者认可准则[accreditation criteria for proficiency testing providers (ISO/IEC17043:2010)][ 6]要求进行了均一性和稳定性评价。EQA样本发放当日由-20 ℃冰箱中取出,保存于含冰袋的运输箱内,由上海市临床检验中心统一发放到各实验室。各实验室在上报检测结果的同时填写所使用的检测方法、仪器、试剂、校准物。
使用上海市临床检验中心的质控数据分析程序进行数据的统计处理(两次剔除±3 SD以外的数据),EQA分析以每个质评物除外均值( ±s)加减3倍标准差(s)后得到的中位数为靶值,按根据美国临床实验室改进修正法案(CLIA’88)可接受范围、基于生物学变异的允许总误差(TEa)3种可接受限[ 7]、卫生部临床生物化学检验常规项目分析质量指标(WS/T 403-2012)[ 8]作为肾功能室间质量评价标准,分别计算不同仪器组参加EQA的及格率(根据Cr参加实验室的数量>18选定分析10套仪器组,其中进口仪器厂家为8家,国产仪器厂家为2家)。统计分析采用SPSS 15.0统计软件,对不同检测仪器间的EQA变异系数( CV)作Wilcoxon符号秩检验分析, P<0.05表示差异有统计学意义。
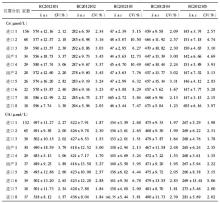
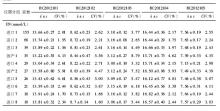
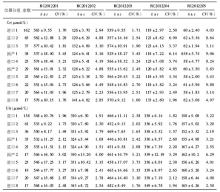
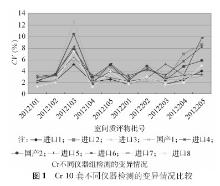
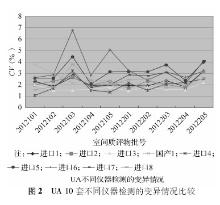
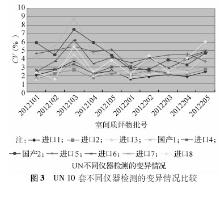
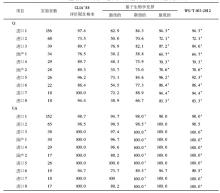
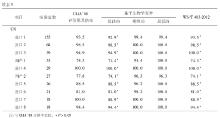
2012年度参与血清Cr EQA的实验室2次分别为502 、504 家, 10套检测仪器的实验室分别为438、440家;参与血清UA EQA的实验室2次分别为471、 472 家, 10套检测仪器的实验室分别为411、413家,参与血清UN EQA的实验室2次分别为501、502家, 10套检测仪器的实验室分别为436、438家。2012年度2次不同检测仪器EQA结果比较,见表1,表2:
对不同检测仪器间的2次EQA CV作Wilcoxon符号秩检验分析得出,对于Cr检测,变异情况较好的前3位分别为进口1、进口8、进口7;对于UA检测,变异情况较好的前3位分别为进口3、进口4、进口2;对于UN检测,变异情况较好的前3位分别为进口2、进口1、进口3。
注:与CLIA’88及格率比较, * P>0.05.
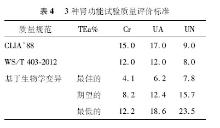
基于平均个体内和个体间变异的肾功能项目的生物学变异数据库已经发表[ 6],3种肾功能试验质量评价标准的TEa,见表4:
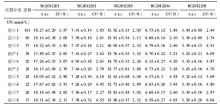
我们比较了2012103批号室间质评物不同仪器组采用不同质量评价标准的肾功能指标及格率,见表3。所检测项目根据CLIA’88能力验证可接受标准、基于生物学变异、卫生部行业标准3种评价标准的及格率不全相同。对于Cr而言,以CLIA’88允许的可接受限作为评价标准的及格率与生物学变异最低的评价结果、卫生部行业标准基本一致;UA的及格率以CLIA’88允许的可接受限作为评价限与生物学变异期望评价限结果、卫生部行业标准基本一致;UN的及格率以CLIA’88允许的可接受限作为评价限与生物学变异最佳评价限结果、卫生部行业标准基本一致。
由于方法学原理、检测系统的差异,肾功能实验检测结果在实验室内和实验室间的存在着不同程度的差异,实验室为临床提供准确可靠的检测结果带来了困扰。
本研究选取上海地区临床实验室常见的10套检测仪器,这些仪器的生产厂家均为规模较大的生产厂商。2012年度EQA结果分析中,Cr、UA、UN不同检测系统 CV范围分别为1.30%~12.73%、1.06%~6.78%、1.55%~8.79%。Cr检测EQA的结果表明,进口1组实验室间的变异情况较其他系统好,进口1系列检测质评物(46~574)μmol/L CV范围为1.70%~5.15%。UA检测EQA的结果表明,进口3组实验室间的变异情况较其他系统好,进口3系列检测质评物(132~550)μmol/L CV范围为1.49%~2.19%;UN检测EQA的结果表明,进口2组实验室间的变异情况较其他系统好,进口3检测质评物3.15~18.13)mmol/L CV范围为1.55%~2.74%。相比较而言,国产检测仪器的性能有待进一步提高。对于Cr检测,国产1 CV范围为3.00%~12.73%;对于UA检测,国产1 CV范围为1.68%~3.79%;对于UN检测,国产1 CV范围为2.07%~4.72%。现有的基础上根据不同的仪器使用不同的评价限可以促进实验室检测质量的提高。
目前我国EQA评价标准为CLIA’88质量要求,主要缺点是CLIA’88质量要求是基于可达到的标准而不是合适的标准,进一步说,当法规或行业规定了可接受的质量规范后,实验室则认为只要达到这个规定的质量规范即可,而不再采用其他更合适的质量规范来改进其分析质量。而目前多数的实验室在此标准上获得的检测结果还可以,但是这种质量规范处于质量规范层次中较低层,而基于生物学变异的质量规范处于等级模式的第2层,优于目前的质量规范[ 9]。实验室需以更加严格的标准来判断自己。Cr以CLIA’88允许的可接受限作为评价标准的及格率与生物学变异最低的评价结果基本一致;UA以CLIA’88允许的可接受限作为评价限的及格率与生物学变异期望评价限结果基本一致;UN以CLIA’88允许的可接受限作为评价限的及格率与生物学变异最佳评价限结果基本一致。我国Cr、UA、UN的国家标准是高于CLIA’88允许的可接受限的,分别与生物学变异最低限、期望、最佳评价限相接近。本研究获得的基于生物学变异及我国国家标准的分析结果与裘海文等[ 10]研究较一致,目前基于生物学变异最佳的质量规范只适用于部分分析性能优秀的项目,而上海地区大多数实验室Cr的检测性能都有待提高。另外,可以看出我国卫生部行业标准的提出,比较切合我国实际,对于提高我国临床实验室的检测质量具有重要意义。
实行标准化计划是提高其检测质量和实现实验室间结果互认的有效手段。在临床化学测定中,量值溯源体系的建立,参考方法和参考实验室的建立等一系列标准化工作对于保证不同实验室测定结果的准确性和可比性非常重要。目前的EQA仅着重于实验室间测定结果的精密性,随着临床化学参考测量系统的成功建立,我们将能够就测定结果的准确性及精密性做更加深入地研究,我们的EQA将实现准确基础上的比较,我们的结果互认也会是准确基础上的可比。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|