类风湿关节炎(rheumatoid arthritis,RA)是一种系统性、慢性自身免疫性疾病。全球近1%的人群患有此病,且以老年人居多,女性发病率明显高于男性,约为男性的3~4倍[ 1, 2]。由于患者在发病2年内即可出现不可逆的骨关节损伤,因此,RA的早期诊断和治疗是防止关节进一步损伤,提高患者生活质量和生存率的关键[ 3, 4, 5]。
研究发现,抗环瓜氨酸肽(cyclic citrullinated peptide,CCP)抗体对于RA的早期诊断具有较高的灵敏度和特异性[ 6, 7, 8],且抗体浓度与患者关节损伤的程度[ 9]以及药物治疗效果[ 10]相关,同时抗CCP抗体能较好地区分各类非RA疾病引起的关节痛和关节炎[ 11, 12]。因此,2009年美国风湿病学会(ACR)和欧洲抗风湿病联盟(EULAR)将抗CCP抗体作为新的RA诊断标准之一[ 13]。
近年来,国外已开展悬浮芯片技术检测自身抗体[ 14, 15]。2010年BioPlexTM 2200全自动免疫分析仪(简称BioPlexTM 2200)检测抗CCP抗体通过了美国食品和药物管理局(FDA)的认证。该检测系统的主要特点包括通量高、吸样量少、特异性高、灵活性好[ 16]。目前,由于国内运用该技术检测抗CCP抗体还处于起步阶段。为了了解悬浮芯片技术及其配套试剂的分析性能和临床实际应用情况,我们对BioPlexTM 2200检测抗CCP抗体的检测性能和初步临床应用进行了评估。
收集131例2012年12月至2013年1月期间至复旦大学附属中山医院风湿科门诊就诊的患者和健康体检者的血清样本,-80 ℃保存至检测。同时排除严重溶血、脂血和黄疸的样本,根据临床诊断将样本分为RA组、非RA疾病对照组(简称非RA组)和正常对照组。
1. RA组 复旦大学附属中山医院风湿科门诊确诊的RA患者65例,年龄26~89岁,诊断标准采用2009年ACR的RA诊断标准[ 13]。
2. 非RA组 46例,年龄29~87岁。包括各类自身免疫性疾病31例(系统性红斑狼疮19例、血管炎5例、自身免疫性肝病2例、干燥综合征4例、混合性结缔组织病1例)和关节痛(炎)患者15例。
3. 正常对照组 复旦大学附属中山医院体检中心表面健康体检者20名,年龄46~87岁。
所有血清样本同时在以下2个检测系统进行检测。检测时各试剂盒均在有效期内,且严格按照厂商规定的操作执行。
1. BioPlexTM 2200 Bio-Rad公司BioPlexTM 2200及配套抗CCP抗体检测试剂(批号:109901)、校准品(批号:47297)和质控品(批号:47263)。检测系统基本特征:检测原理为流式点阵免疫发光法技术,Cut-off值为3.0 U/mL,线性范围为0.5~300.0 U/mL。
2. Roche检测系统 Roche公司Modular E170全自动免疫分析仪及配套抗CCP抗体检测试剂(批号:170489)、校准品(批号:170489-01)和质控品(批号:170489-01)。检测系统基本特征:原理为电化学发光法,Cut-off值为17.0 U/mL,线性范围为7.0~500.0 U/mL。
1. 精密度评估 用BioPlexTM 2200检测高、中、低3种浓度样本,每份样本重复测定20次,连续测定20 d,计算批内、天间的均数()、标准差(s)及变异系数(CV),了解批内、天间不精密度。
2. 线性评估 取高值混合血清与低值混合血清按照4∶0、3∶1、2∶2、1∶3、0∶4的比例进行5点稀释(稀释的5点基本覆盖了线性范围),充分混匀,进行复管检测,并通过多项式回归分析进行线性评估,从而确认最适方程,若最适方程为多项式,则通过计算最适方程与线性之间的平均线性偏倚(ADL),与允许偏倚(5%)进行比较,从而判断是否呈线性[ 17]。
3. 方法学比较 用BioPlexTM 2200和Roche检测系统检测血清抗CCP抗体水平,计算kappa值、总符合率、阳性符合率以及阴性符合率进行一致性分析。
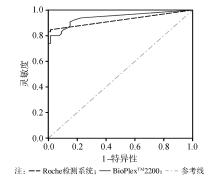
4. 临床应用评估 用BioPlexTM 2200和Roche检测系统分别检测RA组、非RA组和正常对照组抗CCP抗体水平。同时采用受试者工作特征(ROC)曲线分析检测结果,通过计算其曲线下面积(AUC)、最适Cut-off值、 灵敏度、特异性、阳性似然比、阴性似然比,评价RA的临床诊断特性。
所有数据采用SPSS 16.0统计软件进行处理。使用SPSS软件拟合二次、三次多项式回归方程,并将非线性系数与“0”作t检验得到P值,若P<0.05即非线性系数与“0”的差异有统计学意义,判断为非线性,否则判断为线性;ROC曲线分析得到2种检测系统的AUC及最适Cut-off值,采用Z检验比较AUC的差异;通过计算kappa值进行一致性评价,P<0.05为差异有统计学意义。
BioPlexTM 2200线性验证的5个稀释点浓度分别为0.5、67.8、134.6、209.2、294.6 U/mL,检测线性范围的多项式回归分析结果见表2。最适多项式方程拟合值与线性拟合值的ADL<5%,该检测系统在临床可接受范围内判断为线性。
| 表2 BioPlexTM 2200检测系统多项式回归分析 |
| 表3 2种检测系统一致性评估 |
抗CCP抗体作为RA诊断敏感且特异的指标,在RA发病的早期即可出现,而且对于疾病的进展和预后都有着重要的意义。为了满足临床运用需求,抗CCP抗体检测方法在靶抗原选择上不断改进。2000年,Schellekens首次通过化学法固相合成含21位氨基酸的环瓜氨酸肽作为第1代检测抗原,该方法检测特异性约为98%,但灵敏度(41%~68%)低于RF[ 7, 18, 19]。2002年,第2代检测抗原开始广泛应用于临床。该抗原是通过筛选RA患者混合血清从而得到模拟真实构象多肽[ 20],较第1代抗原检测灵敏度明显提高(64.4%~96.0%)[ 21]。为了进一步提高检测性能,第3代检测抗原也在不断地研究中。与此同时,检测技术的发展也带动了检测性能大幅度的改变。悬浮芯片技术作为新兴的高通量检测技术,其分析性能和临床实际应用价值都受到了广泛关注。为了解该新技术及其相应的检测试剂盒的检测性能和临床应用价值,我们对BioPlexTM 2200进行评估,并与Roche检测系统进行比较。
在精密度实验中,3种浓度的混合血清批内和天间CV值均<10%,符合定量试剂要求,能满足临床应用需求。其中,中浓度血清接近医学决定水平(Cut-off值=3.0 U/mL),批内和天间CV均<5%,表明Cut-off值对判断是否存在抗CCP抗体有较高的稳定性。BioPlexTM 2200的精密度与Roche检测系统相似[ 22],且优于传统的酶联免疫吸附试验(ELISA)[ 24]。由于该检测系统的整个反应体系处于均相条件,有利于生物大分子保持其真实的空间构象,从而保证检测结果的稳定性。
在线性评估实验中,BioPlexTM 2200在临床可接受范围内判定为线性,且验证的浓度范围(0.5~294.6 U/mL)基本覆盖了厂商推荐的检测范围(0.5~300 U/mL)。
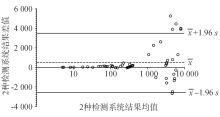
本研究对BioPlexTM 2200和Roche检测系统进行了一致性分析。两者具有较高的总体符合率,且kappa值>0.85,显示两者检测结果一致性较好。这可能与2种试剂盒均采用第2代人工合成的CCP作为检测抗原有关,以此避免了包被不同的抗原肽所引起的差异。以上结果与Wyness等[ 22]的研究基本相符。然而,通过分析Bland-Altman图,发现少数超限标本超出1.96s界限,这可能与目前临床上使用的抗CCP抗体检测系统没有标准化,又缺乏国际参考物质[ 23]有关。因此,不同医疗部门和检测系统之间不可避免存在一定差异,这种现状会给临床应用尤其是不同医疗部门之间的结果比对和资料分析带来困扰。
在初步临床应用研究中,本研究对各组抗CCP抗体检测结果进行ROC曲线分析。结果显示Roche检测系统的灵敏度和特异性略高于BioPlexTM 2200。同时,为了解BioPlexTM 2200确诊及排除RA的能力,本研究计算了其似然比。该检测系统阳性似然比>10,对RA具有较明确的诊断价值。
本研究结果显示131例研究对象中BioPlexTM 2200和Roche检测系统有8例抗CCP抗体结果不符。其中,7例临床诊断为RA,而BioPlexTM 2200检测结果为阴性。Waterboer等[ 24]研究显示,人类血清中可能存在能与BioPlexTM 2200检测试剂微珠直接结合的抗体。微珠与此类抗体结合会引起较强的非特异性背景,对结果可能产生一定的影响。1例临床诊断为系统性红斑狼疮(SLE),BioPlexTM 2200检测结果为阳性。近年来,研究发现SLE患者血清中出现抗CCP 抗体概率为7%~20%[ 25, 26],且抗CCP 抗体的出现可能与SLE关节炎的严重程度相关[ 25]。所以,对于RA的诊断,建议结合临床表现、影像学资料以及其他血清学指标进行联合判断。
由于RA患者在发病的几年内即可出现不可逆的骨关节破坏,因此,临床希望在发病早期即可对RA进行诊断。本研究由于资源有限,仅对病程>2年且已确诊的RA患者进行研究,未能对早期RA患者(首次症状出现<1年)进行随访,无法进一步评估BioPlexTM 2200对早期RA的诊断价值。同时,本研究未能获取RA患者影像学资料,评价抗CCP抗体的滴度与RA患者关节浸润程度之间的关系。因此,在早期诊断RA以及预测骨关节损伤方面,BioPlexTM 2200还尚待更进一步研究阐明。
总体而言, BioPlexTM 2200分析性能较好,对于RA的诊断具有一定的临床应用价值。然而,抗CCP抗体检测试剂的未标准化会导致不同的检测系统结果之间存在差异,所以标准化是今后需要攻克的难题。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|