乙型肝炎病毒 (hepatitis B virus, HBV) 感染引起的乙型病毒性肝炎是我国发病率较高的疾病。在感染HBV的大部分成年人中, 表现为一种急性、自限性的肝脏炎症, 病毒负荷的急剧下降, 长久的保护性体液和细胞免疫, 但在另一部分受染的成年人和大多数经垂直传播而致病的患者中, 持续的病毒感染会最终导致慢性乙型肝炎 (chronic hepatitis B, CHB)[ 1]。然而HBV在机体持续性感染致慢性肝炎发生的病理机制尚未完全阐明。HBV是一种非细胞毒性病毒, 当其进入机体后常引起一系列复杂的免疫反应, 而机体产生的免疫应答的强弱又与HBV感染所致的不同临床结果密切相关。在这一系列免疫应答中, 细胞免疫应答是决定HBV感染机体后转归的最重要因素。辅助性T细胞17 (T helper cell 17, Th17) 是近几年发现的辅助性T细胞 (CD4+T细胞) 新的功能亚群, 主要通过分泌大量的白细胞介素17 (interleukin 17, IL-17) 来发挥生物学效应。目前已证实Th17细胞是急性或慢性炎症环境中重要的效应细胞, 在自身免疫性疾病、炎症反应、肿瘤等的发生、发展中均发挥着重要的作用。至今, 有关Th17细胞与HBV致肝脏慢性免疫性炎症关系的研究在国内外已见少量报道[ 2, 3],研究结果均提示Th17细胞可能在病毒性肝炎慢性化过程中具有重要作用。基于上述原因, 本研究拟对临床不同疾病程度CHB患者和健康人外周血Th17细胞及其效应分子IL-17的水平进行检测, 分析这些变化与患者HBV DNA载量、肝脏损伤标志物等的关系, 旨在进一步证实Th17细胞在CHB慢性免疫炎症损伤过程中的作用。
随机选取2007至2008年在长海医院感染科住院或门诊治疗的93例CHB患者, 男68例, 女25例, 平均年龄 (43±15) 岁, 其中轻度21例、中度37例、重度35例, 诊断依据2005年修订的“慢性乙型肝炎防治指南”标准[ 4]。所有患者没有并发丙型肝炎、丁型肝炎、戊型肝炎、人类免疫缺陷病毒感染和自身免疫性肝炎。28名健康者均为长海医院健康体检者, 其中男17名, 女11名, 平均年龄 (29±8) 岁, 无心、肝、肾等器质性疾病, 亦无乙型肝炎、丙型肝炎、丁型肝炎、戊型肝炎、人类免疫缺陷病毒感染和自身免疫性疾病。本研究经长海医院医学伦理委员会批准, 每位受试对象都签署了知情同意书。
采集CHB患者血液标本时, 有17例接受了核苷类抗病毒治疗, 11例未接受任何治疗, 其余均仅接受保肝降酶治疗, 均未接受甾体类药物治疗。以无菌方式采集各试验对象晨起空腹静脉血, 乙二胺四乙酸抗凝血5 mL用于流式细胞仪检测细胞成分分离;不抗凝血5 mL, 血清用于检测肝功能、HBV DNA、IL-17等。
取乙二胺四乙酸抗凝血100μL, 用100μL含10%小牛血清的RPMI-1640培养液 (Gibco公司) 混合后接种于96孔培养板 (Costar公司),同时加入终浓度为50 ng/mL的佛波醇酯 (Sigma公司) 、1 μg/mL离子霉素 (Sigma公司) 和1 μL/mL布雷菲德菌素A (Becton Dickinson公司) 。在37 ℃、5%CO2培养箱刺激培养5 h。收集体外刺激活化的外周血, 用磷酸盐缓冲液 (phosphate-buffered saline, PBS) 洗涤2次。加入5 μL异硫氰酸荧光素 (fluorescein isothiocyanate, FITC)-抗人CD4 (eBioscience公司),室温避光温育30 min。加入1 mL红细胞裂解液 (BD公司) 室温作用10 min, 洗涤。加入固定穿膜剂500 μL (eBioscience公司),室温作用1 h, 洗涤。分别加入5 μL藻红蛋白 (phycoerythin, PE)-抗人IL-17 (eBioscience公司) 、5 μL别藻蓝蛋白 (allophycocyanin, APC)-抗人γ干扰素 (interferon-gamma, IFN-γ, eBioscience公司) 和同型对照抗体, 室温作用30 min, 洗涤后立即用FACSCalibur流式细胞仪 (BD公司) 检测。以CD4+T细胞设门, 至少计数20 000个细胞, 以CellQuest软件分别IL-17和IFN-γ表达阳性细胞占CD4+T细胞的比例。
采用无柱免疫磁珠细胞分选外周血CD4+细胞, 试剂盒为RosetteSep (加拿大STEMCELL公司),方法为抗体标记和免疫密度离心负筛选法, 具体步骤:取5 mL抗凝全血, 加250 μL CD4+T细胞富集试剂后混匀, 室温作用20 min, 用等量PBS进行稀释并混匀。在另一试管内加入适量淋巴细胞分离液 (上海华精生物高科技公司),将处理好的标本沿管壁缓缓叠加于分层液上, 形成清晰界面。置水平离心机中, 400×g离心20 min。用滴管直接吸出CD4+T细胞层, 加入4倍量以上的Hank’s液, 充分混匀, 300×g离心10 min。用含10%小牛血清的RPMI 1640培养液配制细胞悬液, 将细胞悬液调整到106/mL。取样经FITC-抗人CD4抗体染色后流式细胞仪检测纯度, 代表性结果见图1, 纯度>95%进行下一步试验。按100 μL 2×105/孔的细胞接种96孔培养板, 同时加入终浓度为1 μg/mL CD3 和2 μg/mL CD28功能性抗体 (eBioscience公司),37 ℃、5% CO2孵箱刺激培养5 h进行细胞总RNA抽提, 培养72 h收集上清液进行酶联免疫吸附试验 (enzyme-linked immunoserbent assay, ELISA) 检测。
采用ELISA检测, 试剂盒购于eBioscience公司, 操作严格按试剂盒说明书进行。
采用荧光实时定量聚合酶链反应 (polymerase chain reaction, PCR) 检测患者血清HBV DNA水平, 试剂盒购自深圳匹基生物工程公司。采用速率法检测血清ALT, 试剂盒购于科华生物工程公司, 仪器为日立7600型全自动生化分析仪。
取1×106个经刺激或未刺激CD4+T细胞, 用Trizol试剂 (Invitrogen公司) 抽提细胞总RNA, 逆转录采用TaKaRa PrimeScriptTM RT试剂盒 (TaKaRa公司) 进行。再使用SYBR PrimeScriptTM RT-PCR试剂盒 (TaKaRa公司) 于LightCycler 定量PCR仪 (Roche公司) 进行实时荧光定量PCR。以3-磷酸甘油醛脱氢酶 (glyceraldehyde-3-phosphate dehydrogenase, GAPDH ) mRNA表达量为内参照, 根据待检基因和内参照基因扩增的循环数Ct值, 按照公式相对值=2-ΔΔCT计算出标本中待检基因相对于内参照基因的相对含量。引物序列采用Primer Premier 5.0软件设计, IL-17上、下游引物序列:F-TGTCCACCATGTGGCCTAA-GAG;R-GTCCGAAATGAGGCTGTCTTTGA。RORC上、下游引物序列:F-ACCTCACCGAGGCCATTCAG;R-TAGGCCCGGCACATCCTAAC。GAPDH上、下游引物序列:F-GCACCGTCAAGGCTGAG-AAC;R-ATGGTGGTGAAGACGCCAGT。
采用SPSS 17.0软件包进行分析。结果以±s表示, 各检测指标间的比较采用非参数Kruskal-WallisU rank sum test 进行分析, 指标间相关性采用Kendals tau-b进行分析,P<0.05为差异有统计学意义。
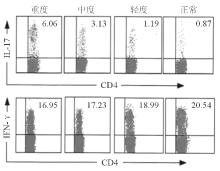
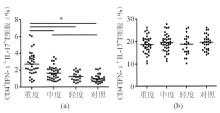
与正常对照组[(0.62±0.58)%]相比, CHB患者外周血CD4+IFN-γ-IL-17+T细胞 (Th17细胞) 的比例[(1.89±1.46)%]明显升高(P<0.05) 。随着疾病的加重, Th17细胞的比例也随之上升。重度组、中度组和轻度组外周血Th17细胞的比例分别为 (2.75±2.89)%、 (1.75±1.58)%和 (1.24±0.98)%,重度组Th17细胞的比例显著高于中度组、轻度组和正常对照组(P<0.05),见图2、图3 (a) 。CHB中度组Th17细胞的比例也显著高于正常对照组(P<0.05) 。然而, 中度组Th17细胞的比例与轻度组、轻度组与正常对照组间差异均无统计学意义(P>0.05) 。同时, 本研究还观察了CHB患者外周血CD4+IFN-γ+IL-17-T细胞 (Th1细胞) 的比例变化及与疾病严重度的关系。结果显示, 各组间Th1细胞占CD4+T细胞的比例差异无统计学意义(P>0.05) 。见图2、图3 (b) 。
注:图中右上角的数字代表其所占CD4+T细胞的比例 (为一次试验的代表图)
注:CD4+IFN-γ-IL-17+T细胞为Th17细胞;CD4+IFN-γ+IL-17-细胞为Th1细胞;(a) 各组Th17细胞比例比较,*P<0.05;(b) 各组Th1细胞比例比较.
未经刺激的CD4+T细胞IL-17和RORC mRNA表达水平各组间差异无统计学意义。然而, CD4+T细胞经抗CD3和抗CD28单抗刺激后, CHB重度组IL-17和RORC mRNA表达水平明显高于轻度组和正常对照组(P<0.05),且IL-17 mRNA表达在中度组与正常对照组间也存在差异, 但CHB重度组与中度组之间、轻度组与正常对照组之间的差异无统计学意义(P>0.05),见图4。
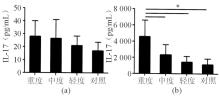
各组间IL-17水平差异无统计学意义(P>0.05),见图5 (a) 。随后, 测定经纯化的CD4+T细胞刺激后的培养液的IL-17水平。与正常对照组相比, CHB患者CD4+T细胞刺激后的培养液中IL-17水平显著升高(P<0.05);且随疾病严重程度的增加, IL-17的表达水平亦随之增加。CHB重度组CD4+T细胞刺激后的培养液中IL-17的水平为 (4 535.69±1 857.31) pg/mL, 明显高于中度组[(2 472.01±1 139.43) pg/mL]、轻度组[(1 664.38±468.20 ) pg/mL]和正常对照组[(1 421.17±471.16) pg/mL](P<0.05),见图5 (b) 。虽然CHB中度组IL-17水平稍高于轻度组和正常对照组, 但差异无统计学意义(P>0.05);轻度组和正常对照组之间也无差异(P>0.05) 。
注:(a) 各组RORC mRNA表达水平的比较;(b) 各组IL-17 mRNA表达水平的比较;*P<0.05
注:(a) 血清;(b) 培养上清液;*P<0.05
肝脏慢性炎症及继发性纤维化是CHB的特征。既往认为CHB患者机体清除病毒能力降低, 致使HBV可在体内持续存在, 导致HBV感染慢性化的免疫机制与Th1和Th2免疫应答失调有关。CHB患者体内的Th1细胞及其免疫应答降低, IFN-γ和IL-2等细胞因子减少, 造成Th1/Th2细胞比例失衡, 直接影响了细胞毒性T淋巴细胞 (cytotoxic T lymphocyte, CTL) 、自然杀伤 (natural killer, NK) 细胞和B细胞功能的正常发挥。本研究发现CHB组外周血Th1细胞比例与正常对照组无明显差异, 且与疾病的严重程度也无关系, 表明HBV感染慢性化不是单一因素作用的结果, 还存在其他的免疫机制。近来, 大量的研究已证实Th17细胞参与了多种肝脏疾病的发生机制, 在酒精性肝病、非酒精性脂肪性肝炎、原发性胆汁性肝硬化等疾病中, Th17细胞发挥了诱导固有免疫应答、中性粒细胞趋化激活、产生炎症反应等作用, 在对肝脏的损伤及疾病的进展中也均起到重要作用[ 5, 6] 。同时, 有文献报道Th17细胞不仅可以上调抗凋亡分子, 促进被病毒感染的细胞存活, 而且可以抑制CTL对靶细胞的破坏, 延长病毒持续感染的时间[ 7]。
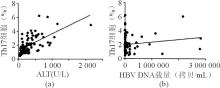
有关CHB疾病过程中Th17细胞的变化、与疾病的关系等研究国内外已有一些报道, 但试验结果却不尽一致。杨波等[ 8]发现, CHB组和HBV相关慢加急性肝功能衰竭 (acute-on-chronic liver failure, ACLF) 组患者外周血Th17细胞频率均显著高于健康对照组, ACLF组又显著高于CHB组患者。ACLF患者外周血Th17细胞频率与国际标准化比值和终末期肝病模型评分均呈正相关, 而CHB患者外周血Th17细胞频率与ALT水平呈正相关, 与HBV DNA载量无关。Qi等[ 9]的研究也得到相似的结果, ACLF患者外周血Th17细胞频率和RORC mRNA表达水平显著高于CHB组, 而CHB组则显著高于健康对照组。然而, Zhang等[ 10]发现CHB患者外周血增加的Th17细胞频率与ALT水平及HBV DNA载量均呈正相关。林振忠等[ 11]也发现CHB患者Th17细胞的频数明显高于健康对照组, 但与总胆红素、直接胆红素和ALT无相关性。本研究结果显示CHB患者外周血Th17细胞比例明显高于正常对照组, 且随着疾病的加重, Th17细胞的比例也随之上升, 表现为重度组Th17细胞比例明显高于中度组、轻度组和正常对照组, 中度组Th17细胞比例也显著高于正常对照组。为了进一步明确CHB患者外周血Th17细胞比例的检测结果, 我们还对Th17细胞分化特异性核转录因子RORC mRNA的表达水平进行了检测, 所获的结果完全佐证上述发现。升高的Th17细胞比例是否与肝脏损伤存在一定的关联?我们发现CHB患者外周血Th17细胞的比例与血清ALT水平呈明显正相关, 而与血清HBV DNA载量无相关性, 这与杨波等[ 8]的报道完全一致。Ye等[ 12]已证实, CHB患者肝内Th17细胞数量与肝脏炎症活动度呈正相关, 该报道也是对本研究结果的有力支持。各文献报道结果有差异, 原因可能与CHB患者病例的入选条件不同有一定关系。在本研究和杨波等的报道中均将CHB按疾病严重程度进行分组, 其中重度组的病例数均﹥30例;而在林振忠等[ 11]的报道中均为CHB病例, 如均为轻度患者, 就较难观察到外周血Th17细胞比例与ALT变化的关联性。
IL-17是Th17细胞分泌的特征性炎性细胞因子, 具有广泛的细胞靶点, 可诱导其他炎性细胞因子、趋化因子和基质金属蛋白酶的表达, 参与中性粒细胞趋化, 引起炎性细胞浸润和组织损伤[ 5, 13]。国内外文献报道, CHB、肝硬化、原发性肝癌和慢性肝功能衰竭患者血清IL-17和外周血单个核细胞IL-17 mRNA水平均比正常对照显著升高, 在CHB和肝硬化患者的肝组织中IL-17的表达也明显增多[ 8, 10, 11, 12, 14]。然而, 这些结果并未获得一致的支持, 一些研究发现CHB患者血清IL-17水平与正常对照者比较无明显差异[ 15, 16]。本研究结果也显示CHB患者血清IL-17水平与正常对照者比较无明显差异。但分析试验对象纯化CD4+T细胞刺激后的培养液时发现, CHB患者CD4+T细胞刺激后的培养液中IL-17的水平明显高于正常对照者, 且随疾病严重程度的增加而增高。试验对象纯化CD4+T细胞经功能性抗CD3和抗CD28单克隆抗体模拟T细胞抗原受体激活CD4+T细胞时, CHB尤其是CHB重度和中度组患者CD4+T细胞趋向于分化更多的Th17细胞, 致培养液中IL-17的水平高于正常对照组和CHB轻度组。关于CHB患者血清中IL-17检测结果的差异, 我们认为可能与Th17细胞在血循环中所占比例甚少, 及CHB患者多存在T细胞免疫功能抑制有关。
综上所述, 本研究的结果提示CHB患者体内增高的Th17细胞可能是造成肝脏炎症、促进肝细胞损伤的主要原因之一, 并与CHB的重症化密切相关。调节性T细胞从CD4+T细胞分化而来, 在分化中所需的部分细胞因子与Th17细胞比较类似, 然而生物学功能却存在一定的拮抗。若能增加未治疗患者病例数, 按治疗与否和不同治疗方案分组, 并做治疗前后相关指标的比较, 则可分析不同治疗方案对相关指标的影响, 以期探讨可用于评价治疗效果的指标。如果在本研究中能够同时分析调节性T细胞的比例及相关转录因子、效应分子等的变化, 将有助于更全面地了解CHB患者的机体免疫状态。外周血Th17细胞比例升高可否作为CHB患者疾病进展的标记?Th17细胞是否可成为治疗CHB的一个新靶点?哪些因素驱动或参与了CHB患者Th17细胞的分化?这些问题均有待于进一步探索。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|