游离脂肪酸(free fatty acid,FFA)又称非酯化脂肪酸,其在血液中的浓度能反映人体脂肪代谢情况,与血脂代谢异常、胰岛素抵抗、代谢综合征以及糖尿病、心血管疾病的发病有密切关系[ 1, 2, 3]。以往检测血清(或血浆)FFA多采用气相色谱法[ 4]或高效液相色谱法[ 5]。但这些方法技术要求较为严格,检测成本高。近年来发展起来的酶学比色法(简称酶法)具有检测方便、成本低廉的优点而受到临床实验室青睐,目前临床上检测血清(或血浆)FFA多采用该方法。酶法测定原理中需要3种酶——乙酰辅酶A合成酶(acyl-CoA synthetase,ACS)、脂酰辅酶A氧化酶(acyl-CoA oxidase,ACOD)和过氧化物酶(peroxidase,POD)。主要原理为FFA在ACS的催化下生成脂酰辅酶A,脂酰辅酶A在ACOD的催化下产生过氧化氢,过氧化氢在POD存在下作用于相应底物产生有色的醌类物质,其吸光度的大小与FFA的浓度成正比。
检验项目的生物学变异具体可分为个体间生物学变异(between-subject or inter-individual biological variation)和个体内生物学变异(within-subject or intra-individual biological variation),两者的大小常用变异系数(CV)表示,分别用符号CVG、CVI(或CVg、CVW)表示,主要用于制定临床实验室质量规范,同一患者系列结果的解释及临床课题的科研设计等。
我们采用美国临床实验室标准化协会(CLSI)EP5-A2和EP15-A文件中描述的方法评价了酶法测定FFA的精密度和正确度,并以13名健康青年志愿者为研究对象,在6周时间内每2周测定1次血清FFA浓度,计算个体间及个体内的生物学变异大小。
选择13名志愿者,男3名,女10名,年龄21~23岁,平均年龄为21.8岁,体质指数(BMI)为18.49~26.50 kg/m2,平均为21.72 kg/m2,无心血管疾病史,无手术史,不吸烟,不饮酒。实验前进行的实验室检查显示血脂类常规生化指标均正常。本实验通过当地伦理委员会审查,所有志愿者均签署知情同意书。
1. 试剂和仪器 血清FFA酶法试剂盒及校准品购自北京九强生物技术有限公司,批号分别为12-0401P、12-0720P、13-0125P。仪器为UniCel DxC800全自动生化分析仪(美国贝克曼库尔特公司),采用海尔DW-86L386超低温冰箱(-80℃)保存样品,采血针和真空生化采血管(含促凝剂)购自湖北金杏科技发展有限公司。
2. 精密度评价 按照CLSI EP5-A2文件的精密度评价要求进行实验[ 6]。以新鲜混合血清作为实验样品,使用另一份新鲜混合血清作为质控血清,都分装成足够实验用的小份于-80 ℃保存,避免反复冻融。每一批测定FFA浓度(试剂批号12-0401P)时,样品和质控各取1份,且样品重复测定2次,质控测定1次。每天测定2批,间隔时间不少于2 h。连续测定20个工作日(2012年5月),其中在前5 d结束后做初步精密度试验,即在同一批中重复测定样品20次,根据EP5-A2文件中方法判断有无失控批,同时在实验过程中根据每批的质控结果判断有无失控批,如有则去除该日结果,继续测够20 d。实验完成时共得到80个样品测量结果,根据该结果计算批内、批间、日间和室内不精密度。
3. 正确度评价 按照CLSI EP15-A文件的正确度评价要求进行实验[ 6]。测定上海市临床检验中心提供的3个浓度水平的血清FFA室间质评样品(试剂批号:13-0125P),测定过程中同时做室内质控,保证测定时未失控,将测定结果与相应的靶值比较计算偏差。
4. 生物学变异实验的样品采集及检测 所有参加实验的志愿者在整个实验阶段保持正常饮食、学习和工作。采血前一天22∶00以后保持空腹直到采血完成,且不进行强体力运动。采血时间为周五早上7∶00,在检验科由一名固定的采血人员采集静脉血4 mL,采血部位均为左上肢肘正中静脉,使用的采血材料是采血针和真空生化采血管(含促凝剂)。样品采集后放置30 min,2 100×g离心5 min,提取血清,保存在-80 ℃冰箱,直到检测使用。实验过程中每名志愿者共采集4次样品,每2次的间隔时间为2周,整个实验持续时间为6周(2012年11月至12月)。测定血清FFA时每名志愿者的4个样品要在同批测定,所有样品使用同一试剂盒(批号:12-0720P),在最短时间内完成检测。
1. 批内(即重复性)、批间、日间和室内不精密度(即总不精密度)的计算[ 6] 先计算标准差(s),然后除以总的测量均数得到CV,用CV表示各个不精密度大小。批内标准差用Sr表示,公式:
Sr=Ii=1 2j=1(Xij1-Xij2)24I,在该式中及以下公式中I代表总的运行天数(本研究中为20 d),j为每日的批次(本研究为2批),xij1为第i日第j批第1次的结果。批间s用Srr表示,公式:S2rr=A2-S2r2,
A=Ii=1(xi1-xi2)22I,式中xi1为第i日第1批测量结果的均值。日间s用Sdd表示,S2dd=B2-A22,
B=Ii=1(xi..-x...)2I-1,式中xi为第i日结果的均值,x...为所有结果的均值。室内s用ST表示,
ST=S2dd+S2rr+S2r。
2. 偏差的计算[ 6] 偏差=测量结果-靶值,百分比偏差=100%×(测量结果-靶值)/靶值。
3. 个体间生物学变异(CVG)、个体内生物学变异(CVI)的计算[ 7, 8] 血清FFA浓度经自然对数转换后成为正态分布数据。计算个体间生物学变异的方差(VG)和个体内变异的方差(VW)是通过SAS9.1软件MIXED方差分析过程,把FFA浓度的对数值作为应变量,把不同采血时间作为自变量,把实验对象作为随机变量(RANDOM变量)。由于是经过对数转换成为正态分布,故将上步得到的相应方差求平方根即可得到CVG和个体内变异(CVW)值。CVW又包括CVI和分析变异(CVA)。CVI通过下列公式计算,CVI=CV2W-CV2A。CVA源于上述精密度评价实验中得到的批内不精密度。P<0.05为差异有统计学意义。
一、根据初步精密度试验和每批质控数据判断,在20 d共40批样品测定中未出现失控批。样品的FFA浓度总均值为0.796 mmol/L,批内、批间、日间和室内的不精密度见表1:
| 表1 酶法测定血清FFA的批内、批间、日间和室内不精密度 |
注:CV=(s/ )×100%,=0.796 mmol/L.
厂商声明的重复性为5%,总不精密度的合格标准按照室间质量评估允许FFA误差(25%)的1/4计算,为6.25%[ 9]。可见实验获得的用户重复性低于厂家声明,总不精密度低于合格标准,故不需做重复性或总不精密度比较的卡方检验[ 6]。
二、实验测定的室间质评样品血清FFA浓度经与靶值比较得到的偏差、百分比偏差见表2。根据上海市临床检验中心室间质评血清FFA的允许误差(25%)判断,实验测定的3个质评样品的偏差均在允许误差范围内。正确度评价的合格标准按照室间质量评估允许FFA误差的1/2(12.5%),则2号和3号质评样品的偏差能达到合格标准。
| 表2 实验测定室间质评样品的偏差和百分比偏差结果 |
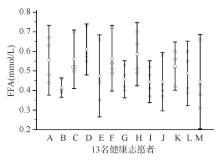
三、生物学变异实验中测得的所有样品的FFA浓度先经自然对数转换,通过Shapiro-Wilk正态性检验为正态分布(P=0.458>0.05)。血清FFA的CVG、CVI和CVA分别为8.43%、19.36%、2.15%。13名健康志愿者在6周时间内4次测定血清FFA水平的变化情况见图1:
临床检验诊断中应用的常规血脂代谢指标主要有高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)、极低密度脂蛋白胆固醇(VLDL-C)及总胆固醇(TC)、甘油三酯(TG)、脂蛋白(a)[Lp(a)]和载脂蛋白A1(apo A1)、载脂蛋白B(apo B)等。血清FFA是新的血脂类生化代谢指标[ 10],主要来源于脂肪酶水解TG或TC而产生的脂肪酸,根据分子链中是否有不饱和双键及不饱和双键数量多少可分为饱和脂肪酸、单不饱和脂肪酸和多不饱和脂肪酸。酶法测定的血清FFA浓度包含有上述各种脂肪酸的总浓度。多数文献已证实2型糖尿病患者血清FFA含量高于正常人[ 3, 11, 12, 13]。FFA参与胰岛素抵抗[ 1]和动脉粥样硬化斑块的形成[ 2]等病理生理过程。酶法试剂盒最初从国外进口,进口试剂以其稳定和优秀的分析性能使得许多实验室仍在使用,但进口试剂盒的价格昂贵,检测成本较高。本研究选择了国产酶法试剂盒,首先按CLSI EP5-A2文件和EP15-A文件中描述的方法对酶法的精密度和正确度进行简单评价。实验中获得的重复性(2.15%)低于厂家声明(5.00%),同时总不精密度(5.46%)能达到公认的合格标准(6.25%)。其中批间不精密度(3.44%)和日间不精密度(3.67%)均高于批内不精密度(2.15%),故批间和日间不精密度是本实验室总不精密度的主要来源。李义龙等[ 9]评价了进口FFA酶法试剂盒的精密度,高、低两浓度水平样品的总不精密度分别为2.20%和3.30%,均优于本研究中获得的总不精密度,而他们实验中2个浓度样品的总不精密度主要来源都仅是批间不精密度(2.10%和1.80%)。本研究测定了上海市临床检验中心室间质评血清FFA项目的3个浓度水平的样品,测定结果的百分比偏差从低浓度样品到高浓度样品依次为24.20%、-0.90%、-1.50%,均在室间质评规定的允许误差范围内。然而以此次测定室间质评样品的结果做正确度评价,则低浓度样品的百分比偏差超过了正确度评价的合格标准(12.50%),其他2个样品的百分比偏差都能达到该合格标准。
CVI是正常人体内被检测物质浓度在连续几次测定时发生变化的重要因素。有学者认为是人体内的某物质围绕其稳态点的上下波动[ 14]。这种变化(或波动)大小在不同物质间会有很大差异,也就是说不同物质的CVI不同。目前大部分临床检验项目的CVG和CVI都已经有大量文献可供参考,然而由于受到研究对象、样品采集间隔时间、实验研究时间长短等实验设计因素的影响,相同的检验项目在不同文献中报道的生物学变异大小也不一致。了解某个项目的生物学变异大小最简便的方法是查看生物学变异的汇编数据库,例如Sebastian-Gambaro等[ 15]发表的汇编数据库文章、美国Westgard网站上Ricos等[ 16]的汇编数据库。在Westgard网站上不仅有各个检验项目的CVG、CVI值,还给出了基于生物学变异计算的各个检验项目的合适精密度和正确度性能指标以及允许总误差,这对于制定检验项目的临床质量规范是非常有价值的参考依据。此外在检验医学领域基于生物学变异还能计算的指标包括个体化指数(II)、参考变化值(RCV)、准确估计稳态点需要的最少测定次数等[ 14]。在临床课题的科研设计中,一般认为单次测定能反映被测物在体内的代谢水平,可如果考虑了被测物的生物学变异,那会使所进行的科学研究更严谨。目前关于生物学变异的统计处理方法尚未统一,不同作者所采用的方法不完全相同。早在1989年该领域著名的学者Fraser和Harris共同发表了临床化学工作中开展生物学变异研究的综述性文章[ 7]。以后各国学者发表的生物学变异的论文绝大多数采用他们介绍的方法[ 17]。在该方法中计算个体间、个体内生物学变异及分析变异的方差采用嵌套设计资料的方差分析。在分析前要进行正态性检验,并进行Cochran、Reed检验检查有无离群值,如有则去除,保证在进行方差分析时数据是正态分布且没有异常值。应用该方法把本研究的原始数据重新计算得到血清FFA的CVG和CVI分别为9.72%和18.84%,与本研究采用混合线性模型方差分析过程[ 8]得到的结果相似。相比较而言,本研究所用方法更简便,适用性更广。血清FFA的生物学变异研究文献很少,在汇编数据库中也未查到该项目。Widjaja等[ 8]曾报道血清FFA的CVG、CVI分别为32%、45%,与本研究得到实验结果略有不同(CVG、CVI分别为8.43%、19.36%)。本研究的CVI值低于文献报道的原因可能与样品采集周期和研究时间长短有关,在Widjaja等[ 7]的研究中连续12 d每天采集健康人血样品,而本研究测定了更长一段时期(6周)内的CVI,结果一般会偏小。本研究CVG值也低于文献报道,这可能与选择的研究对象之间更相近有关。本研究生物学变异的计算中用到了CVW。CVW实际上是除外病理因素,包括所有能引起被检物质浓度变化的变异总和[ 8]。具体可分为分析前变异、CVA和CVI。本研究未计算分析前变异,是由于从样品采集时间、采集部位、空腹时间及饮食运动状态等到样品离心、样品保存条件等都有严格限制要求,尽量缩小分析前变异,故分析前变异成分可以忽略不计。还有在实验中还要求每名健康志愿者的4个样品在同一批测定,为了是在计算中用到的分析变异大小可以等同于批内不精密度大小。
本研究的不足和局限性在于:第一,CLSI EP5-A2精密度评价文件常用于自建检验系统精密度的确立,并推荐使用2个浓度水平的实验样品,尽可能选择接近医学决定水平的浓度,然而该文件也可用于检验系统精密度的验证评价,做验证评价的缺点是实验步骤及统计过程繁琐、复杂。如果实验目的仅是核实厂家声明的精密度和正确度,可选择CLSI EP15-A文件中叙述的简便方法。为了获得更丰富的精密度评价结果,本研究选择了EP5-A2文件中叙述的方法,但由于实验条件限制简化了实验内容,只做了1个浓度水平的实验样品。第二,正确度评价的主要方法是CLSI EP9-A文件中叙述的方法,但对于本研究评价血清FFA的正确度,很难找到所需参考方法或比较方法,也就很难按照EP9-A文件的方法去做正确度验证,故本研究选择了EP15-A文件中描述的检测权威机构提供的室间控制品的实验方案。这不同于测定商品化的定值质控品,对于后者由于厂家赋值程序不同,故需谨慎采用。第三,因为本研究做方法学评价时选择方法较简单,所以实验中获得的精密度和正确度仅用于本实验室的性能核实,具有一定的局限性,对使用该试剂盒的其他实验室仅供简单参考。
本研究中使用的酶法测定FFA的精密度和正确度能满足用户实验室质量规范要求。血清FFA的CVG和CVI可为制定临床实验室质量规范、同一患者系列检验结果的解释以及临床课题的科研设计等提供有用的参考依据。
| [1] |
|
| [2] |
|
| [3] |
|
| [3] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|