通讯作者:周正,联系电话:0531-86568101。
作者简介:王俊玲,女,1974年生,学士,主管技师,主要从事微生物流行病学研究。
采用Meta分析评价酶联免疫吸附试验(ELISA)检测支气管肺泡灌洗液(BALF)半乳甘露聚糖(GM)诊断侵袭性肺曲霉菌病(IPA)的准确性和诊断临界值。
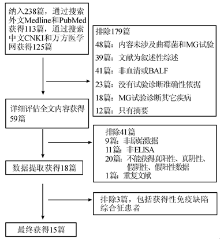
方法检索PubMed、EMBASE、Medline、中国期刊全文数据库(CNKI)、万方医学网等数据库, 检索时间2007年5月至2013年2月,对符合纳入标准的15篇文献(包括22组数据)进行质量评价、异质性分析、合并效应量、受试者工作特征(ROC)曲线及不同临界值分析。
结果BALF GM试验诊断IPA的合并敏感性为0.70(95%可信区间0.66~0.74),合并特异性为0.93(95%可信区间0.92~0.95),ROC曲线下面积为0.90(95%可信区间0.87~0.92),阳性似然比和阴性似然比分别为14、0.29。当临界值为0.5、0.8、1.0时,合并敏感性分别为0.75、0.69、0.68,合并特异性分别为0.89、0.94、0.96。
结论从现有的文献来看, BALF GM试验诊断IPA具有较高的敏感性和特异性,当临界值为1.0时,BALF GM试验可以更有效地检出IPA,对临床具有辅助诊断价值。
近年来侵袭性肺曲霉菌病(invasive pulmonary aspergillosis, IPA )发病率逐渐增高, 特别是在血液病、恶性肿瘤、中性粒细胞减少和造血干细胞移植等患者中具有较高的发病率, 该病已经成为免疫功能低下患者致死的主要原因[1]。其中, 重症监护室患者的IPA发病率为0.3%~5.8%, 致死率超过80%[2]。目前, 半乳甘露聚糖(galactomannan , GM)试验在IPA诊断中得到广泛应用, 大量研究证实GM具有诊断价值, 且对其连续检测, 有助于IPA的早期诊断和用药指导[3]。Ascioglu等[4]首先报道了血清GM抗原的双夹心酶联免疫吸附试验(enzyme-linked immunosorbent assay, ELISA), 该法检测限可达0.5~1.0 μ g/L。随后多项研究发现, 在IPA诊断中, 支气管肺泡灌洗液(bronchoalveolar lavage fluid, BALF) GM试验优于血清GM 试验。尽管这些研究提示BALF GM试验是较好的IPA诊断方法, 但各研究之间对于临界值的选择或敏感性、特异性的评价还存在较大差异, 有必要对已有文献做系统分析, 以判断其最佳临界值、敏感性和特异性等。本研究通过Meta分析的方法, 筛选并评价BALF GM试验在诊断IPA方面的最佳临界值及其敏感性和特异性等评价指标。
计算机检索PubMed、EMBASE、Medline、中国期刊全文数据库(CNKI)、万方医学网, 收集国内外2007年5月至2013年2月公开发表的关于BALF GM试验检测曲霉菌病的相关文献。中英文检索词包括:曲霉菌病(aspergillosis)/曲霉菌(Aspergillus)/半乳甘露聚糖(galactomannan)/支气管肺泡灌洗液(bronchoalveolar lavage fluid)/甘露聚糖(mannans)/临界值(Cut-off)/诊断(diagnosis)。并从相关文章的参考文献中查找可能符合纳入标准的文献。
IPA患者(包括临床确诊IPA患者、疑似IPA患者), 诊断IPA金标准采用欧洲癌症治疗组织/真菌病研究组(European Organization for Research and Treatment of Cancer/Infectious Diseases Mycoses Study Group, EORTC/MSG)制定的IPA诊断标准[5]或类似标准。
纳入标准:(1)已公开发表的研究; (2)研究对象为经过BALF GM试验检测过的患者; (3)研究主题是BALF GM试验诊断IPA的临床价值; (4)原始资料完整, 可提取四格表; (5)检测方法为ELISA。
排除标准:(1)对文献进行质量评价, 重复报告的文献; (2)报告信息太少以至无法利用的文献; (3)资料分析方法有误或不提供; (4)提供数据前后不一致; (5)研究对象和研究主题不符; (6)研究对象包括获得性免疫缺陷综合征患者。
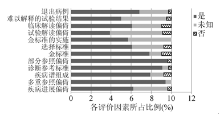
依据Whiting等[6]制定的诊断准确性研究的质量评估(quality assessment of diagnostic accuracy studies, QUADAS)来评价文献的质量, 内容包括:(1)疾病谱组成; (2)选择标准; (3)金标准; (4)疾病进展偏倚; (5)部分参照偏倚; (6)多重参照偏倚; (7)混合偏倚; (8)待评价试验实施; (9)金标准的实施; (10)试验解读偏倚; (11)金标准解读偏倚; (12)临床解读偏倚; (13)难以解释的试验结果; (14)退出病例, 共14个标准按照“ 是” 、“ 否” 、“ 不清楚” 进行评价, 见图2。
按照Meta分析的要求整理数据, 建立数据库并核校数据, 计算敏感性、特异性、阳性似然比、阴性似然比、诊断优势比、受试者工作特征(receive operating characteristic, ROC)曲线下面积, 曲线下面积越接近1, 表示诊断试验的准确性越高, 同时表明该项检验的诊断价值也越高。采用Metadisc和Stata 12.0专用软件进行统计分析。用χ 2和I2进行异质性分析, P值和I2评估异质性大小:若P> 0.1, I2≤ 50%, 则认为无明显统计学异质性, 选择固定效应模型进行Meta分析; 若P< 0.1, I2> 50%, 认为研究间有异质性, 有明显统计学异质性的研究选用随机效应模型进行Meta分析[6]。
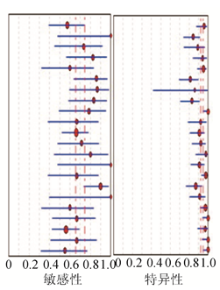
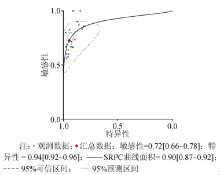
1.15篇文献(22组数据)的合并敏感性为0.70(95%可信区间0.66~0.74), 合并特异性为0.93(95%可信区间0.92~0.95), 见图3; 阳性似然比是14, 阴性似然比是0.29, 见图4; 异质性检验结果分别为:χ 2=35.46, P=0.019 2; I2=41.8%, P< 0.05, 则存在统计学异质性, 选用随机效应模型; ROC曲线下面积为0.90(95%可信区间0.87~0.92), 见图5。
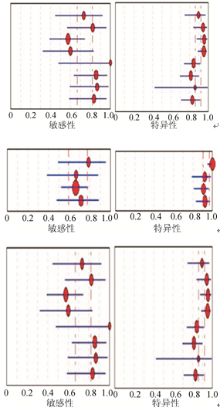
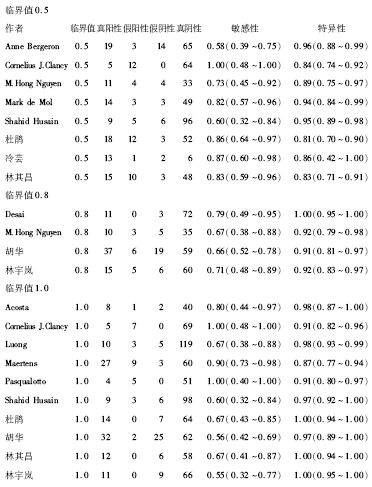
2.GM试验临界值的Meta分析见图6。8篇文章显示, 当临界值为0.5时, 敏感性为0.75(95%可信区间0.67~0.82); 特异性为0.89(95%可信区间0.86~0.92); ROC曲线下面积为0.91(95%可信区间0.88~0.93); 诊断优势比为30.92。4篇文章显示, 当临界值为0.8时, 敏感性为0.69(95%可信区间0.59~0.78); 特异性为0.94(95%可信区间0.90~0.97); ROC曲线下面积为0.82(95%可信区间0.78~0.85); 诊断优势比为28.80。10篇文章显示, 当临界值为1.0时, 敏感性为0.68(95%可信区间0.61~0.74); 特异性为0.96(95%可信区间0.94~0.97); 曲线下面积为0.94(95%可信区间0.92~0.96); 诊断优势比为74.12。结果显示, 随着临界值增高, GM试验的敏感性下降, 而特异性升高。因此纳入研究的合并效应值分析和ROC曲线分析结果认为, 当临界值为1.0时, 准确性和综合效能较高。
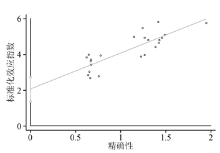
3.发表偏倚的识别见图7。Meta分析属于观察性研究, 在设计、分析过程中或存在偏倚, 造成部分研究结果缺失而引起发表偏倚。经Egger's检验发现, 纳入文献的发表偏倚结果是P< 0.001, 表明所纳入的文献发表偏倚较小。
'> | 图7 15篇文献的Egger's检验 |
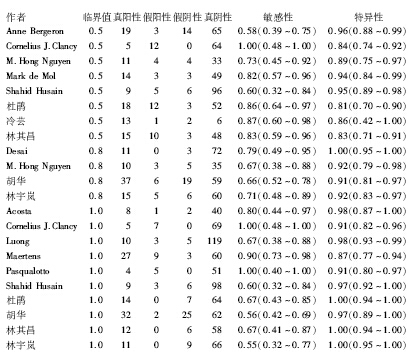
本研究依据QUADSA标准共纳入15篇文献(22组数据), 结果显示, BALF GM试验诊断IPA的合并敏感性为0.70(95%可信区间0.66~0.75), 其漏诊率为30%, 合并特异性为0.93(95%可信区间0.92~0.95), 则误诊率为7%; 当阳性似然比> 5且阴性似然比< 0.3时, 具有较强的诊断效能, 本研究的阳性似然比是14, 提示通过BALF GM试验检测出阳性患者的概率是阴性的14倍, 阴性似然比是0.29, 提示BALF GM试验检测IPA错误判断阴性的概率是正确的29%, 说明BALF GM试验有很高的诊断价值, 漏诊率较低。ROC曲线下面积为0.90(95%可信区间0.87~0.92), 曲线下面积接近1, 说明其诊断效能较高。对纳入文献进行Egger's偏倚分析, 结果是P< 0.001, 所有文献均分散在直线周边, 说明纳入文献发表偏倚较小。
随着免疫抑制剂、广谱抗菌药物的滥用以及器官移植、导管留置操作的普及, IPA的发病率不断升高。 传统诊断方法如肺部计算机断层扫描IPA特有的征象— — 晕轮征(halo Sign)样结节和空气新月征见于40%~69%的早期病例[7], 由于影像学诊断IPA的敏感性和特异性较低, 已满足不了临床诊断的需要。国内报道通过分子生物学方法对BALF和血液进行研究, 其特异性达到89%[8], 与本研究结果相近, 但由于检测成本高, 不适用于实验室检测。本研究显示BALF GM试验具有较高的诊断效能, 且检测成本低, 适用于各实验室。
本研究为了增加阳性预测值, 降低假阳性结果的出现, 又分别讨论了3种临界值BALF GM试验的敏感性和特异性。临界值为0.5、0.8、1.0时, 敏感性为0.75、0.69、0.68, 特异性为0.89、0.94、0.96, ROC曲线下面积为0.91、0.82、0.94。当临界值为1.0时, 诊断优势比和ROC曲线下面积的结果均高于其它临界值结果, 虽然敏感性略低, 但是特异性较高, 因此选择临界值为1.0作为BALF GM试验的临界值, 可以具有较高的敏感性和特异性, 此结果与国外Leeflang等[9]报道基本一致。同样的试剂和方法测定曲霉抗原, 不同国家和地区判定的临界值尚不统一, 欧洲多采用1.0或1.5的临界值标准, 且连续2次阳性提示GM试验阳性; 而2003年美国食品药品监督管理局将临界值下调至0.5, 虽然敏感性有一定提高, 但会增加可疑阳性范围, 给诊断带来很大的差异[10]。我们通过研究15篇文献得出, BALF诊断IPA的最佳临界值为1.0。
目前检测血清GM试验已成为EORTC/MSG中诊断IPA的一项重要指标, Pfeiffer等[11]对GM试验进行Meta分析发现, 在诊断恶性肿瘤患者IPA中GM试验的敏感性为70%, 特异性为92%; 而诊断造血干细胞移植患者IPA时, 敏感性和特异性均为82%; 但是诊断实体器官移植患者IPA时, GM试验的敏感性较低, 为22%, 特异性则为84%。对比BALF和血清GM检测的诊断效率, 本研究显示BALF GM试验的敏感性和特异性均高于血清GM试验, 主要与曲霉菌侵犯肺, 感染局部器官曲霉菌载量较高有关。抗真菌药物或其它药物的应用也常影响试验结果, 国外学者通过试验证实抗真菌治疗对血清GM试验影响比BALF GM试验大[12], 因此BALF GM试验相比血清GM试验更加稳定, 药物干扰更小。
总之, 本研究发现BALF GM在诊断IPA方面具有较高的敏感性和特异性, 并且我们发现其最佳的临界值为1.0。但仍存在以下不足:(1)纳入的个别文献中没有区分确诊IPA、可疑IPA、可能IPA、非IPA; (2)纳入的标本类型不同, 纳入文献中的吸光度值也不同, 文献质量有限且发表年代跨度稍大, 因此可能会影响Meta分析结果; (3)由于本研究纳入人群年龄层次不同, 可能会导致人群分组存在偏倚。随着研究的不断深入, 仍然有必要进一步探讨BALF GM试验在不同的人群、临床诊断、治疗和预后判断中的价值。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|