耐甲氧西林金黄色葡萄球菌(methicillin-resistantStaphylococcus aureus,MRSA)是临床常见的重要病原菌,具有多重耐药性,由其引起的临床感染所占的比例呈逐年上升的趋势,给临床治疗带来极大困难。MRSA的致病能力强,可引起菌血症、败血症、中毒休克综合征等多种进行性、坏死性疾病[ 1, 2]。来自全球监测数据显示MRSA的发生率达40%~50%,而且不同种族、不同地区来源的MRSA在致病性、耐药性及基因多态性等方面有显著差异[ 3]。因此,了解各民族、各地区MRSA的分子流行特征为制定预防措施及有效防止MRSA的爆发流行具有十分重要的意义。本研究通过葡萄球菌染色体mec(Staphylococcal cassette chromosomemec, SCCmec)基因分型、多位点序列分型(multi-locus sequence typing, MLST)及杀白细胞毒素(Panton-Valentine leukocidin, PVL)毒力基因(pvl)检测等技术,对鄂尔多斯地区蒙古族54株MRSA菌株进行基因分型研究,同时与主要流行克隆株进行比较和分析,以了解本地区MRSA的分子生物学特征。
1. 菌株来源 收集2009年1月至2011年8月在鄂尔多斯市中心医院门诊及住院的蒙古族患者,连续分离不重复血、腹腔渗出液、封闭脓汁、下呼吸道痰标本、支气管灌洗液以及尿液、伤口分泌物等标本MRSA分离株共54株,均经VITEK-32全自动细菌鉴定仪鉴定,同时使用美国临床实验室标准化协会(Clinical and Laboratory Standards Institute, CLSI)[ 4]推荐的头孢西丁纸片扩散法验证MRSA,判读标准:抑菌圈直径≤19 mm。mecA基因检测均阳性。金黄色葡萄球菌(ATCC 25923)质控菌株购自卫生部临床检验中心。
2. 仪器与试剂 美国贝克曼公司的超速低温离心机;美国Alpha Innotech有限公司的紫外凝胶成像仪;Gene Amp基因有限公司PCR9700;BIO-RAD电泳仪;细菌基因组提取试剂盒购于上海生物工程有限公司;Taq酶、Marker及聚合酶链反应(polymerase chain reaction, PCR)相关试剂购于宝泰克生物科技有限公司;PCR所有引物均由上海生工生物技术有限公司合成。
1. 细菌基因组提取 采用上海生物工程有限公司的细菌基因组提取试剂盒,依照说明提取基因组DNA,产物保存-70 ℃冰箱中备用。
2. SCCmec基因分型 多重PCR 引物及反应体系等参数参照文献[5]进行。使用Gene Amp基因有限公司PCR9700进行PCR扩增,PCR扩增产物在1%琼脂糖凝胶上电泳,溴化乙锭(ethidium bromide, EB )染色,紫外凝胶成像仪观察是否出现目的条带,并拍照成像。PCR产物送上海生工生物技术公司纯化并双向测序,测序结果在网站 (http://www.ncbi.nih.gov/) 进行BLAST对比,明确其基因型。
3. PVL毒力基因检测 每株MRSA均PCR进行毒力筛查,引物及反应体系等参数参照文献[6],基因片段位于第1 640~2 072位点,扩增产物为433 bp。扩增产物电泳后全自动凝胶成像系统观察结果并拍照保存。扩增阳性产物送上海生工生物技术公司测序。
4. MLST 7个管家基因分别是arcc、aroe、glp、guk、pta、tpi和yqil,其扩增引物及反应参数参照文献[7]进行。电泳、测序、序列比对同前,测序结果用DNAMAN软件进行比对后,将结果提交数据库(http://www.mlst.net),比较每个多态性位点的等位基因,获得序列号(ST),并与已知的MRSA流行株进行比较和分析。
对鄂尔多斯地区蒙古族54株MRSA菌株进行SCCmec基因分型,SCCmecⅡ型27株,占50.00%,SCCmec Ⅲ型25株,占46.30%;SCCmec Ⅳ型1株,占1.85%;SCCmecⅤ型1株,占1.85%;未检测到SCCmecⅠ型菌株。Ⅱ~Ⅴ型测序结果与GenBank BLAST比对,结果分别与参考序列D86934、 AB37671、 AB063172 、AB12121一致。SCCmecⅤ型代表菌株测序图谱见图1:
54株MRSA均进行了pvl基因的PCR扩增,结果显示仅1株SCCmec Ⅳ型MRSA菌株的pvl基因阳性,分离率为1.85%,代表株测序图谱见图2, 其余菌株均为阴性。
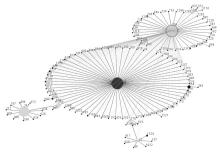
挑选27株MRSA进行MLST分型,其中SCCmec Ⅲ型14株,SCCmec Ⅱ型11株,SCCmec Ⅳ型1株,SCCmec Ⅴ型1株。有24株MRSA成功进行分型,其中有1株SCCmec Ⅲ型和2株SCCmec Ⅱ型未能进行MLST分型。24株MRSA共有4种序列型,其中13株为ST239,占54.17%;9株为ST5,占37.50%;ST59和ST7各1株,占4.17%。通过eBURST软件绘制了所测试的24株菌株和不同ST型别之间的系统进化树,见图3~图5:
注:ST5 (中心圆点外圈)的克隆复合体(CC5)分析图,初级始祖为ST5(中心圆点),单位点变异体由长线段相连;双位点变异体由中、短线段相连
同时,SCCmec基因型与MLST分型结果之间具有一定的关联性,见表1:
| 表1 SCCmec基因型与MLST分型的对应关系 |
1961年Jevons在英国首次发现MRSA,20世纪60年代中期MRSA扩展到欧洲许多国家及加拿大,20世纪70年代末急剧增多遍及全世界,并引起爆发流行,成为全球性问题[ 8]。不同国家、不同地区间流行的MRSA基因型不同,目前SCCmec分型成为最常用的分型方法之一,已经广泛应用于科学研究,依照SCCmec各基因组分的多态性将SCCmec分为Ⅰ~XI 型[ 9],根据无功能区的不同又可以分为不同的亚型。本研究对鄂尔多斯地区蒙古族患者进行SCCmec分型,结果显示SCCmecⅡ型和Ⅲ型是本地区的主要型别,分别占50.00%和46.30%。这与国内、外相关报道相近[ 10, 11],表明本地区蒙古族人群MRSA分子流行病学特征仍与主要流行株一致。在治疗方面,有国内外相关经验可以借鉴,如吴爱武报道的MRSA对克林霉素、β-内酰胺酶类抗菌药物100%耐药,而对其他药物表现为多重耐药[ 12]。本研究还发现Ⅳ型和Ⅴ型各1例菌株,特别是Ⅴ型在国内蒙古族人群中很少见到报道,但Ⅳ型和Ⅴ型在欧洲某些国家为主要表型[ 13],表明与国外流行株有交叉,原因可能与鄂尔多斯地区的地理位置与蒙古国毗邻及其过快的发展速度有关,导致来源于世界流行株在本地区携带传播。随着国家和地区间经济文化交流的日益频繁,感染更具有复杂性和多样性。同时,有研究报道SCCmec分型是区分医院感染和社区获得性感染的一个重要指标,但是本地区蒙古族人群及门诊标本较分散,不利于调查随访,而且社区获得性感染标准国际与我国尚未统一,不利于区分。因此,我们应该通过加大样本量等措施,进一步探明本地区社区获得性感染MRSA流行株的SCCmec型别、分布情况及抗菌药物耐药的携带情况,这有待我们进一步研究探讨。
PVL是一种与致病力相关的外毒素,能与葡萄球菌细胞表面结合,直接导致皮肤及软组织感染、坏死性肺炎、坏死性筋膜炎等严重坏死性疾病[ 14],对MRSA进行pvl基因检测尤其重要。本研究对所有MRSA进行了pvl基因的PCR扩增,结果显示仅1株MRSA的pvl基因阳性,其他均未检出pvl基因,可能与pvl基因为社区获得性感染特有的标志有关。有研究显示,世界上流行的社区获得性感染MRSA产pvl的比例高达77%~100%[ 15],而在医院感染MRSA中pvl基因的检出率<0.5%。又如Zhang等[ 5]进行相关研究,发现所有117株社区获得性感染MRSA均包含pvl基因,而医院MRSA菌株pvl基因均未检测出。本次研究中,pvl基因扩增阳性率较低的原因,可能和地域特征及民族特征有一定的关系,不同地区、不同民族的阳性率可能也不同[ 16]。同时本研究发现的pvl阳性菌株是SCCmec Ⅳ型,这也揭示pvl阴阳性结果可以初步作为区分社区获得性感染MRSA和医院感染MRSA标准之一,因为Ⅳ、Ⅴ型多见于社区获得性感染MRSA[ 17]。
目前,国际上主要有5个MRSA克隆株[ 18],包括巴西/匈牙利克隆株、伊比利亚克隆株、纽约/日本克隆株及儿童克隆株。本研究通过对24株MRSA菌株进行MLST,总共发现4个不同的ST型,发现本地区MRSA菌株主要由两大克隆株进化而来,一个为SCCmec Ⅲ-ST239,归属于CC8克隆复合体,来源于巴西/匈牙利克隆株,是亚洲地区亦是国内其他地区广泛流行的克隆株;另一个为SCCmecⅡ-ST5,归属于CC5克隆复合体,来源于纽约/日本克隆株,是在韩国和日本广泛流行的克隆株;另外本地区的Ⅳ型菌株为SCCmec Ⅳ-ST59,归属于CC59克隆复合体,与美国、新加坡及中国台湾地区广泛传播的社区获得性感染MRSA克隆株相同[ 19],考虑为输入性病例引发疾病所致; SCCmec Ⅴ型菌株为ST7型,因数据有限,尚无法追踪其根源。
综上所述,本研究通过SCCmec分型、pvl基因检测及MLST 3种方法,发现鄂尔多斯地区蒙古族人群MRSA并非是单一流行株,而以SCCmec Ⅲ型和SCCmec Ⅱ型两大克隆株为主,另外近年来在欧美地区迅速流行的SCCmec Ⅳ、Ⅴ型菌株也已经通过各种途径传播到本地区。本研究不足之处在于社区获得性感染MRSA患者多在门诊或急诊科就诊,通常患者仅仅进行简单的外科处理或经验性用药,很少送检,造成检出率较低,而且毒力基因的检测仅局限于pvl,而没有对其他毒力基因如hla、hlb、clf及fnb等进行检测。另外,进行MLST分型的菌株数量较少,均有待于我们进一步完善研究。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|