作者简介:张磊,女,1981年生,学士,技师,主要从事临床医学检验工作。
通迅作者:林萍,联系电话:021-64387250。
分析抗菌肽人β防御素3(hBD3)对肺炎克雷伯菌临床分离株的抑菌作用。
方法合成抗菌肽hBD3,分别通过最低抑菌浓度(MIC)检测、直接杀菌试验、重要功能基因检测分析其对20株临床分离的肺炎克雷伯菌的直接抑制作用;并将其与阿莫西林、头孢他啶、环丙沙星联合应用,观察其对抗菌药物50%最低抑菌浓度(MIC50)和90%最低抑菌浓度(MIC90)的影响。
结果hBD3对20株肺炎克雷伯菌的MIC为(22.3±6.6)μg/mL;在浓度达到8 μg/mL时即有明显的杀菌作用。hBD3可上调
抗菌肽hBD3对肺炎克雷伯菌有明显的抑制作用,可望与抗菌药物联用治疗肺炎克雷伯菌感染。
To analyze the inhibition effects of antimicrobial peptide human β defensin 3(hBD3) against
Antimicrobial peptide hBD3 was synthesized. The direct inhibition on 20
The MIC of hBD3 against
There is a considerable antibacterial activity of antimicrobial peptide hBD3 against
肺炎克雷伯菌在自然界广泛存在,是临床最常见的条件致病菌之一,也是临床分离的主要的革兰阴性菌之一。随着各类广谱抗菌药物的广泛应用,出现了大量多重耐药的肺炎克雷伯菌,包括产超广谱β内酰胺酶(extended spectrum β lactamase,ESBL)的肺炎克雷伯菌[ 1]。目前,联合应用抗菌药物仍然是治疗耐药性肺炎克雷伯菌感染的主要方案,但敏感抗菌药物的选择越来越困难,急需其他有效的应对方案。
目前,对抗菌药物外的感染应对手段的研究主要包括噬菌体[ 2]、细胞壁水解酶、溶菌酶以及抗菌肽(antimicrobial peptide,AMP)等[ 3]。AMP是一类小分子量蛋白,对细菌、病毒、真菌具有广谱抗菌活性。其中,人β防御素(human β defensin,hBD)是重要的人体AMP,人体多种细胞均可分泌hBD。hBD在人体非特异性抗感染免疫以及免疫调节过程中具有重要地位[ 4]。hBD3能够在人体血清(生理性盐浓度)中发挥抑菌活性,因而最具应用潜力[ 5]。
我们以hBD3为研究对象,收集临床分离的肺炎克雷伯菌,分别通过体外抑菌试验、重要功能基因表达改变以及对抗菌药物头孢他啶、环丙沙星和阿莫西林50%最低抑菌浓度(50% minimal inhibitory concentration,MIC50)、90%最低抑菌浓度(90% minimal inhibitory concentration,MIC90)的影响,探讨将抗菌肽hBD3与抗菌药物联合应用治疗肺炎克雷伯菌感染的可行性。
从临床分离的20株肺炎克雷伯菌于2011年7月至12月收集自上海交通大学医学院附属瑞金医院。抗菌肽hBD3由上海赛百盛生物科技有限公司合成[ 6],全长为45个氨基酸(含形成二硫键的6个半胱氨酸),根据NCBI数据库,序列为GIINTLQKYYCRVRGGRCAVLSCLPKEEQIGKCSTR-GRKCCRRKK。药敏试验MH肉汤及琼脂购自上海博微生物科技有限公司;细菌RNA抽提、反转录及定量聚合酶链反应(polymerase chain reaction,PCR)试剂盒等均购自天根公司;96孔细胞培养板购自BD公司;ABI 7500 FAST荧光定量PCR扩增仪由美国ABI公司生产。
| 表1 肺炎克雷伯菌 ompC及 yojL基因扩增所用的引物序列 |
1. 抗菌肽hBD3对肺炎克雷伯菌的体外抑菌试验
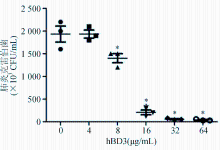
分别通过MIC测定和体外定时杀菌试验检测hBD3的杀菌活性。(1)MIC测定:按照梯度稀释的方法,在96孔细胞培养板上用水解酪蛋白胨(MH)肉汤稀释冻存的hBD3,浓度分别为256.0、128.0、64.0、32.0、16.0、8.0、4.0、2.0、1.0、0.5 μg/mL,每孔100 μL,再将浓度为1个麦氏单位的20株肺炎克雷伯菌分别用MH肉汤稀释100倍,每孔加入100 μL。各孔的hBD3终浓度分别为128.00、64.00、32.00、16.00、8.00、4.00、2.00、1.00、0.50、0.25 μg/mL,将96孔细胞培养板置于37 ℃孵育18 h,直接观察各孔是否有细菌生长;以没有细菌生长的最低hBD3浓度作为hBD3对肺炎克雷伯菌的MIC值;(2)定时杀菌计数:用新鲜培养的20株肺炎克雷伯菌菌株分别配制成1×106 CFU/mL的菌悬液,分置6个实验管,每个实验管3 mL,分别加入hBD3直至终浓度为0、4、8、16、32、64 μg/mL,置于37 ℃孵育3 h,分别以梯度稀释平板涂布法检测各实验管的活菌浓度。
2. 抗菌肽hBD3对肺炎克雷伯菌 ompC和 yojL基因表达的影响
用新鲜培养的20株肺炎克雷伯菌菌株分别配制成1×106 CFU/mL的菌悬液,加入hBD3直至终浓度为10 μg/mL,置于37 ℃孵育3 h,抽提其mRNA,以16 srDNA基因为内参,用实时定量PCR(Q-PCR)的ΔΔCT方法检测肺炎克雷伯菌 ompC和 ycjV基因的表达情况,计算公式为实验组表达量/对照组表达量=2-ΔΔCT。RNA抽提、反转录及Q-PCR均严格按操作说明书进行。
3. 抗菌肽hBD3作用于肺炎克雷伯菌后对头孢他啶、环丙沙星、阿莫西林MIC50和MIC90的影响
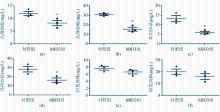
选用上述相同的微量肉汤稀释法,检测阿莫西林、头孢他啶、环丙沙星对每株肺炎克雷伯菌的MIC。在此基础上,计算得到MIC50和MIC90。对于每株肺炎克雷伯菌临床分离株,在将1麦氏单位浓度的菌株稀释100倍时,另作一组加入抗菌肽hBD3使得菌液的hBD3浓度为10 μg/mL,即抗菌肽hBD3的最终作用浓度为5 μg/mL。将96孔细胞培养板置于37 ℃孵育18 h,直接观察各孔是否有细菌生长,确定当有/无抗菌肽hBD3时抗菌药物作用于不同临床分离株的MIC。分析联用抗菌肽hBD3后各抗菌药物MIC50和MIC90值的变化情况。
抑菌试验、基因表达检测及对抗菌药物MIC的影响均进行3次独立实验,取各自结果的平均值和标准差。采用SPSS17.0软件进行统计分析。不同实验组间的存活菌菌量比较采用 t检验, P<0.05为差异有统计学意义。
MIC测定结果显示抗菌肽hBD3对肺炎克雷伯菌的MIC为(22.3±6.6) μg/mL。在体外定时杀菌试验中,当hBD3终浓度达到8 μg/mL时,3 h后的菌量与对照组有明显差异( P<0.05),见 图1。
根据Q-PCR测得的循环数(CT)计算所测基因的相对表达量,以16 srDNA基因为内参,并以实验组表达量/对照组表达量的比值>2判为表达上调,<0.5判为表达下调。结果显示抗菌肽hBD3使 ompC基因的表达明显上调,其相对表达量为2.43±0.67; yojL基因的表达明显下调,其相对表达量为0.36±0.19。
在联用终浓度为5 μg/mL的抗菌肽hBD3后,头孢他啶和环丙沙星的MIC50值、MIC90值明显降低,而阿莫西林的MIC50值、MIC90值则无明显变化,见 图2。
肺炎克雷伯菌是医院感染的重要条件致病菌之一。随着β-内酰胺类及氨基糖苷类广谱抗菌药物的广泛使用,产ESBL的多重耐药肺炎克雷伯菌的感染率不断上升,给临床抗感染治疗带来了严峻挑战[ 9]。与其他抗菌材料一样,抗菌肽被认为是可望用于治疗肺炎克雷伯菌感染的备选抗菌制剂之一[ 10]。
由于抗菌肽的稳定性相对有限,在评价抗菌肽抑菌能力时,多数研究选用短时(1~3 h)的直接杀菌试验来进行评估[ 11];也有研究认为应该选用经典的常用于抗菌药物药敏试验的肉汤稀释法MIC测定来确定抗菌肽的抑菌能力[ 12]。本研究分别使用这两种方法分析了抗菌肽hBD3对肺炎克雷伯菌的抑菌作用。结果显示抗菌肽hBD3对肺炎克雷伯菌的MIC为(22.3±6.6) μg/mL;而在3 h杀菌试验中,8 μg/mL的hBD3即对肺炎克雷伯菌有明显的杀菌作用。这一方面证实了抗菌肽的抑菌作用确实受到其本身稳定性的制约;另一方面也提示在分析抗菌肽的抑菌作用时,最好同时采用这两种方法并分别提供检测结果。
本研究检测了抗菌肽hBD3对肺炎克雷伯菌 ompC和 yojL基因表达的影响。结果显示,hBD3使 ompC的表达上调, yojL的表达下调。 ompC编码肺炎克雷伯菌外膜蛋白。有研究[ 8]显示,与抗菌药物敏感的肺炎克雷伯菌相比,抗菌药物耐药的肺炎克雷伯菌的 ompC基因表达更低。这一现象部分原因可能是耐药菌株在抗菌药物的选择下增加了各种耐药基因的表达,进而下调了外膜蛋白基因的表达。肺炎克雷伯菌的 yojL基因编码蛋白与多种药物转运有关[ 13],属于转运蛋白的ATP结合组分。 yojL基因的下调可能意味着抑制肺炎克雷伯菌的药物外排能力,从而增加其对抗菌药物的敏感性。
本研究还分析了联用抗菌肽hBD3后头孢他啶、环丙沙星和阿莫西林MIC50和MIC90值的变化。结果发现抗菌肽hBD3能有效降低头孢他啶、环丙沙星的MIC50和MIC90值。这一结果表明,虽然抗菌肽的临床应用尚待时日,但将抗菌肽与现有的抗菌药物联合应用,不失为应对耐药病原体扩散的有效手段之一。
作为参与机体非特异性和特异性抗感染免疫的重要组分,不断有新的、各具特色的抗菌肽的抑菌作用得到证实。在抗菌肽的相关数据库[ 14]中已经收录超过2 400种不同的抗菌肽。绝大多数抗菌肽为人和动物来源,其中包括hBD3在内的人源性抗菌肽的应用前景更加值得关注。未来抗菌肽的临床应用应当围绕人源性抗菌肽来进行,将其与现有抗菌药物或者其他抗菌制剂联用,以应对多种感染性疾病的威胁。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|