作者简介:曾章锐,男, 1986年生,硕士,主要从事细菌耐药的机制研究。
通讯作者:邵海枫,联系电话:025-80860176。
探讨临床分离的铜绿假单胞菌对头孢吡肟(FEP)敏感性低于头孢他啶(CAZ)的原因。
方法收集临床分离的经Vitek 2 Compact全自动微生物分析系统检测PEF最小抑菌浓度(MIC)高于CAZ MIC的铜绿假单胞菌60株,琼脂稀释法复查FEP和CAZ的MIC值,聚合酶链反应(PCR)扩增耐药基因,实时荧光定量PCR分析细菌外排系统表达情况。
结果手工琼脂稀释法检测与Vitek 2 Compact全自动微生物分析系统检测存在5%的差别, PCR扩增发现部分菌株存在编码KPC和PSE-1的耐药基因,外排系统表达显示以
FEP敏感性低于CAZ的主要原因可能是编码KPC与PSE-1的耐药基因的存在和外排系统mexAB-OprM、mexCD-OprJ表达增加共同作用的结果。
To investigate the reasons of less susceptibility mechanism to cefepime (FEP) than to ceftazidime (CAZ) in clinical isolates of
A total of 60 isolates of
The 5% of error rate was showed between agar dilution method and Vitek 2 Compact system. There were isolates with KPC and PSE-1 resistance genes by PCR amplification. There were mainly the expressions of
Less susceptibility to FEP than to CAZ in clinical isolates of
头孢吡肟(cefepime ,FEP)是第4代头孢菌素类的代表药物,在治疗铜绿假单胞菌引起的院内获得性感染中起着重要的作用。在FEP未大量应用前FEP和头孢他啶(ceftazidime ,CAZ)对临床分离的铜绿假单胞菌的敏感性往往一致[ 1],但在FEP大量使用后,临床上出现了铜绿假单胞菌FEP敏感性低于CAZ的表型株。国外有文献报道,该表型出现的主要原因是mexXY-OprM[ 2]外排系统的过度表达,以及OXA-1、OXA-10、OXA-31、OXA-35或PSE-1型[ 3]耐药酶的出现。本试验主要是对南京军区南京总医院出现的该表型菌株介导基因进行相关研究。
1.菌株来源
从南京军区南京总医院临床各科室分离的经Vitek 2 Compact全自动微生物分析系统及其配套的GN-13药物敏感性卡(法国生物梅里埃公司)检测FEP最小抑菌浓度(minimal inhibitory concentration, MIC)高于CAZ MIC(FEP与CAZ的MIC比值≥2)的60株铜绿假单胞菌(编号:1~60,剔除同一患者分离的重复菌株)作为试验组。对照组为临床各科室分离的FEP敏感性与CAZ一致的铜绿假单胞菌30株(编号:61~90)。质控菌株:铜绿假单胞菌(ATCC 27853)。
2.试剂和仪器
亚胺培南(imipenem ,IPM,美国默沙东公司)、CAZ(葛兰素史克公司)、FEP(中美上海施贵宝制药有限公司),水解酪蛋白胨琼脂、药物敏感性纸片和LB培养基(Oxoid公司),RNAiso Plus(D9108A)总RNA提取试剂盒(TaKaRa公司);iScriptTM cDNA Synthesis Kit和iTaqTM Universal SYBRGreen Supermix(Bio-rad公司),聚合酶链反应(polymerase chain reaction,PCR)扩增仪(Eppendorf公司),801凝胶电泳图像分析系统(捷达公司), Bio-rad电泳系统(Bio-rad公司),ABI 7500 real-time PCR system(ABI公司)。
1.体外药物敏感性试验
按美国临床实验室标准化协会(Clinical and Laboratory Standards Institute,CLSI)(2012)标准用琼脂稀释法检测和判读菌株对IPM、CAZ和FEP的MIC值。
2.耐药基因扩增
试验组中,根据FEP与CAZ的MIC比值(2、4、8、16)将细菌分为4组,每组随机选取2株共8株菌;对照组根据FEP与CAZ均敏感、中介和耐药,分别随机选取3株。检测基因包括编码OXA-1、OXA-10、OXA-48、KPC、PSE-1、VIM-1、GES-1、SME-1和IMP-1酶的基因,引物见 表1。煮沸法提取细菌总DNA作为模板,反应体系:总反应体系50 μL,按PCR试剂说明书加样。循环参数:94 ℃预变性10 min,94 ℃ 30 s,退火(OXA-1、OXA-10和OXA-48退火温度为50 ℃,KPC和PSE-1为53 ℃,VIM-1、GES-1、SME-1和IMP-1为55 ℃)30 s,72 ℃ 90 s,循环30次;最后延伸72 ℃ 10 min。反应结束后取5 μL PCR产物在15 g/L琼脂糖中进行凝胶电泳。
3. 外排系统基因表达量检测
采用实时荧光定量PCR检测 mexB、 mexD、 mexF和 mexY 4种外排基因的表达量。方法如下:用RNAiso Plus试剂盒提取细菌的总RNA,使用iScriptTM cDNA Synthesis Kit进行总RNA逆转录cDNA操作,最后用iTaqTM Universal SYBRGreen Supermix在ABI 7500 real-time PCR system定量分析上述4种基因的mRNA表达量。所用引物(由上海英骏公司合成)见 表1,铜绿假单胞菌(ATCC 27853)为正常对照组, rspl基因为内参基因。反应体系:20 μL,包括iTaqTM Universal SYBRGreen Supermix 10 μL,上、下游引物各0.4 μL, ddH2O 7.2 μL,cDNA 2 μL。反应条件:95 ℃预变性30 s,95 ℃ 5 s,60 ℃ 34 s,40个循环;溶解曲线为95 ℃ 15 s ,60 ℃ 1 min,95 ℃ 15 s。每个样本测定重复3次,且每次设置3个重复孔,以 rpsl基因作为内参基因。使用的ABI 7500 real-time PCR 仪自带的定量分析软件进行结果分析。外排泵表达判定标准依据国外Cabot等[ 15]报道, mexB大于2倍, mexD、 mexF、 mexY大于5倍为增加。
4.外排系统调控基因的扩增和测序
对过度表达外排系统的调控基因 mexR、 nalC、 nalD( mexB)、 nfxB( mexD)进行扩增,引物见 表1。扩增产物送上海Invitrogen公司测序,测序结果与GenBank数据库上对应的调控基因进行对比。
| 表1 本研究所用的PCR引物 |
| 续表 1 |
试验组60株菌中有3株(5%)菌琼脂稀释法与Vitek 2 Compact全自动微生物分析系统的药物敏感性结果不符,其CAZ的MIC值低于或等于FEP,余下的菌株中FEP与CAZ的MIC比值为2的15株,为4的18株,为8的18株,为16的6株。对照组中61~72号菌株为FEP和CAZ敏感,73~77号菌株为FEP和CAZ中介,78~90号菌株为FEP和CAZ耐药。
8株试验组菌株中,44号和53号菌株扩增出KPC的基因,8、11、34号菌株扩增出编码PSE-1的基因,另外3株未检测出编码OXA-1、OXA-10、VIM-1、GES-1、SHV-1和IMP-1的耐药基因。9株对照组细菌中,2株耐药细菌均检出编码IMP-1的基因,敏感和中介的6株细菌未检出编码OXA-1、OXA-10、VIM-1、GES-1、PSE-1、SHV-1 、IMP-1和KPC的耐药基因。见 图1。
8株试验组菌株进行外排系统基因表达量检测,发现以 mexB和 mexD基因表达量增加为主,其他外排系统表达个别增加。对照组中9株细菌药物敏感性为中介的74号和76号菌株 mexB少量表达增加,其他外排系统未发现表达增加。见 表2。
| 表2 8株细菌的MIC和外排系统表达情况 |
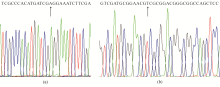
对试验组的过度表达 mexB的3个调控基因测序发现,5株细菌基因出现 nalC Gly70→Glu(GGG→GAG),其它2组调控基因未发现有意义的突变,3株 mexD过度表达的调控基因出现 nfxB Gly109→Val(GGC→GTC)。对照组中74号和76号株的外排系统 mexB的调控基因没有发现有意义的改变。见 图2。
铜绿假单胞菌是医院获得性感染的主要条件致病菌之一。第4代头孢菌素类抗菌药物是治疗铜绿假单胞菌感染的主要药物。但由于该类抗菌药物的大量使用,使铜绿假单胞菌对该类抗菌药物的耐药率逐年增加,敏感性明显下降。目前在铜绿假单胞菌中引起该类抗菌药物耐药的主要机制为β-内酰胺酶的产生和外排系统的过度表达等。
本研究对试验组的8株细菌和对照组的9株细菌选取目前已知的能够引起PEF敏感性低于CAZ的PSE-1、OXA-1、OXA-10进行耐药基因扩增,另外同时还对其它不确定的5种基因进行筛选。从试验组中4组耐药基因检测的结果发现,有5株扩增出耐药酶基因,其中8、11、34号株扩增出编码PSE-1的基因,44和和53号菌株产KPC酶,由于选取的试验菌株较少,没有发现4组试验组中耐药基因的分布存在明显区别。PSE-1酶主要引起PEF、头孢匹罗和氨曲南敏感性下降,对碳青霉烯类抗菌药物和CAZ无影响[ 16],本研究药物敏感性结果也反应出产PSE-1的3株细菌只有FEP耐药,而CAZ敏感;另外2株产KPC酶的细菌出现对IMP、FEP和CAZ均耐药,这2种酶的检测结果与对应菌株的药物敏感性试验结果一致。从对照组中我们却发现,引起铜绿假单胞菌对IMP、FEP和CAZ均耐药且FEP和CAZ敏感性一致的是引起碳青霉烯类药物耐药的最常见的编码金属酶IMP-1的基因,而对照组中的敏感组和中介组没有发现本研究中检测的耐药基因。说明在耐药基因检测方面,试验组的耐药组与对照组的耐药组之间以及试验组的敏感组与对照组的敏感组和中介组之间也存在明显的区别。至于对照组中另一株耐药菌没有检测出耐药基因可能是由于该菌株携带有本研究检测之外的其他碳青霉烯酶耐药基因。另外,我们还发现44号和53号菌株产碳青霉烯酶KPC的基因,该基因最早在肺炎克雷伯菌中被发现,2007年在铜绿假单胞菌中被发现[ 17],在我国2011年首次报道出现在铜绿假单胞菌中[ 18]。这也是南京军区南京总医院首次在该菌中发现该碳青霉烯酶,该酶可以引起菌株对所有β-内酰胺类抗菌药物耐药。
本研究还对试验组中4组共8株细菌和对照组3组共9株细菌外排系统的表达进行分析。在试验组中,发现所有菌株外排系统基因 mexY表达增加不明显。 mexB增加较明显,该外排系统过度表达可以引起FEP的敏感性下降[ 14],其中4、8、16、28和44号菌株表达增加。据有关文献报道,外排系统 mexD的过度表达也可以引起FEP的敏感性低于CAZ[ 14]。在本研究中,未扩增出耐药基因的4号和8号菌株 mexD基因表达增加。对过度表达的外排系统调控基因测序分析发现存在碱基的突变,这可能是引起外排系统表达增加的原因。另外,外排系统 mexF主要引起碳青霉烯类和喹诺酮类抗菌药物敏感性改变,本研究发现有4株细菌出现少量增加。本研究结果发现,外排系统表达量仅少量增加,其中未检测出耐药基因的4、16和28号菌株的 mexB、 mexD基因表达也为少量增加,这可能与这些菌株对FEP和CAZ的药物敏感性试验为敏感或中介有关。由于我们选择试验组中每组细菌的数量较少,没有发现4组细菌之间存在因为FEP/CAZ比值的差别而出现的外排系统表达的差别,没有耐药基因的菌株其细菌外排系统升高,有的细菌含有耐药基因,其外排系统表达也升高。在对照组中,除了中介的2株细菌的外排系统 mexB表达有少量增加外,其它敏感组和耐药组的细菌均无外排系统过度表达。而且该2株细菌的外排系统 mexB表达量与试验组相比存在明显的差别,试验组外排系统表达比对照组高2倍以上,该耐药中介表型细菌的外排系统轻度表达增高可能是由于受到临床使用FEP等药物的刺激,但还没有引起明显改变,所以在检测外排系统调控基因时,这2株细菌没有发现有意义的改变。而南京军区南京总医院已经出现对IPM和FEP耐药而对CAZ敏感的菌株,其机制就是mexAB -OprM等[ 19]外排系统过度表达。因此,在外排系统表达上,试验组的耐药组与对照组的耐药组之间以及试验组的敏感组与对照组的敏感组和中介组之间也存在明显的区别。另外,在药物敏感性结果中有3株菌琼脂稀释法与Vitek 2 Compact全自动微生物分析仪的结果不符,可能由仪器检测的系统误差引起,具体原因不明。
从试验组与对照组的耐药基因检测和外排系统表达情况看,本研究检测的试验组8株细菌中,引起细菌FEP敏感性低于CAZ的原因是编码PSE-1、KPC的基因和外排系统过度表达,与对照组9株细菌中检测的编码IMP-1的基因和外排系统表达情况存在明显的区别。因此,本研究结果表明,出现的FEP敏感性低于CAZ的菌株可能是由于产KPC和PSE-1型耐药酶以及外排系统 mexB和 mexD表达增加共同引起。其中编码KPC的基因在南京军区南京总医院首次发现,该酶的具体研究将在本实验室的下一步试验进行。编码KPC的基因在铜绿假单胞菌中的出现具有警示作用,为防止和预防铜绿假单胞菌中该型耐药基因在医院的流行提供需要信息。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|