尽管伴随大规模疫苗接种, 我国乙型病毒性肝炎的发病率已明显下降, 但就全世界范围而言, 我国仍是乙型肝炎病毒 (hepatitis B virus, HBV) 的重度流行区域之一。在感染HBV后, 超过90%的成人可从急性感染自愈, 并获得终生免疫保护, 但少数急性患者及儿童患者常进展为慢性乙型肝炎 (chronic hepatitis B, CHB),并可能最终导致肝硬化和原发性肝癌等严重肝脏疾病[ 1]。早期的研究发现, 与急性自限性感染患者不同, 慢性感染患者普遍存在T细胞功能缺陷, 这被认为是病毒难以清除的主要原因[ 2]。随后多项研究证实, 病毒抗原持续刺激所致的抗原特异性T细胞功能耗竭是造成T细胞功能缺陷的重要原因[ 3]。更进一步的研究发现, 这种抗原特异性T细胞功能耗竭的现象不仅出现在多种慢性感染性疾病中, 同时也出现在肿瘤的免疫病理过程中[ 4]。
鉴于抗原特异性T细胞在清除病毒及肿瘤细胞方面具有关键作用, 其功能可能与这些慢性病毒性感染性疾病或肿瘤的预后密切相关, 目前对这方面的研究愈趋重视。人类白细胞相关抗原 (human leukocyte antigen, HLA) 限制性多肽 (或称之为抗原表位) 存在于HBV蛋白质抗原的多肽链中。目前在HBV特异性CD8+细胞毒性T淋巴细胞 (cytotoxic T lymphocyte, CTL) 识别的21个HBV抗原表位中, 有16个是HLA-A2限制性的[ 5]。此外HLA-A*2402是我国人口中常见的HLA-Ⅰ型等位基因之一[ 6]。HBV特异性CTL可以识别主要组织相容性复合物 (major histocompatibility complex, MHC)-Ⅰ类分子与细胞内合成的病毒蛋白肽复合物, 通过对病毒相关抗原表位的识别、活化, 经穿孔素、颗粒酶依赖的途径杀伤感染肝细胞, 或通过Fas/FasL途径启动靶细胞的凋亡, 以及通过细胞因子如γ干扰素 (interferon-gamma , IFN-γ) 等的非细胞杀伤途径抑制病毒的复制。在本研究中, 我们利用MHC四聚体标记技术对CHB患者外周血中HBV抗原特异性CD8+ T细胞的数量和功能进行了初步分析, 并观察其与临床指标的联系。
经临床确诊的CHB患者35例, 男26例, 女9例, 年龄22~79岁, 中位数45岁, 诊断标准依据2010版国家“慢性乙肝防治指南”[ 7]。所有研究对象的HLA-A等位基因均为A02或A24。所有患者在受试前6个月内均未进行过抗病毒治疗或IFN治疗, 均排除同时感染丙型、丁型肝炎病毒和人类免疫缺陷病毒 (human immunodeficiency virus, HIV) 等。
1.试剂及抗体 藻红蛋白 (phycoerythrin, PE) 标记HLA-A2402与HBV 核心 (core) 117~125抗原肽 (EYLVSFGVW) 或HBV聚合酶 (pol) 756~764抗原肽 (KYTSFPWLL) 四聚体 (Tetra) 复合物, PE标记HLA-A0201和HBV core18~27抗原肽 (FLPSDFFPSV) 或HBV包膜 (env) 335~343抗原肽 (WLSLLVPFV 或env348~357 GLSPTVWLSV) 四聚体复合物均购自Proimmune公司;多甲藻叶绿素蛋白 (peridinin chlorophyll protein, PerCP)-Cy5.5-抗 CD19、异硫氰酸荧光素 (fluorescein isothiocyanate, FITC)-抗白细胞介素2 (interleukin 2, IL-2) 、别藻红蛋白 (allophycocyanin, APC)-抗IFN-γ和 APC-Cy7-抗CD8抗体购自BioLegend和BD-pharmingen公司;高尔基体阻断剂布雷菲德菌素A购自eBioscience公司;穿膜剂saponin购自Invitrogen公司;离子霉素和佛波醇酯购于Sigma公司。淋巴细胞分离液购自上海精华试剂厂。
2.流式细胞术分析 10 mL肝素抗凝静脉血经淋巴细胞分离液分离外周血单个核细胞 (peripheral blood mononuclear cell, PBMC) 后, 1×106个PBMC先加入2 μL四聚体进行标记, 室温作用1 h。四聚体标记结束后, 细胞使用磷酸盐缓冲液 (phosphate-buffered saline, PBS) 洗涤。进一步标记PerCP-Cy5.5-抗CD19或APC-Cy7-抗CD8针对膜抗原的抗体, 室温温育30 min, PBS洗涤。需进行胞内细胞因子抗原检测的, PBMC先以终浓度1 μg/mL离子霉素和50 ng/mL佛波醇酯进行刺激5 h, 刺激同时添加终浓度为10 μg/mL布雷菲德菌素A。细胞先标记四聚体和膜抗原, 洗涤后细胞再加入固定穿膜剂500 μL后, 4 ℃作用过夜。PBS洗涤后, 加入FITC-抗 IL-2或APC-抗IFN-γ抗体, 室温孵育30 min。洗涤后, 采用BD公司CantoII流式细胞仪收集细胞, Diva软件进行数据分析。
3.其他指标测定 血清丙氨酸氨基转移酶 (alanine aminotransferase, ALT) 的测定在Beckman Coulter UniCel DxC800系统上完成;HBV表面抗原 (hehpatitis B surface antigens, HBsAg) 等指标的测定在雅培ARCHITECT PLUS i2000系统上完成;血清HBV DNA载量测定采用实时荧光定量聚合酶链反应 (polymerase chain reaction, PCR),试剂购于深圳凯杰公司, 最低检出限为500 IU/mL。
采用Prism5.0软件进行统计学分析。PBMC四聚体标记阳性细胞患者组与阴性患者组之间比较采用秩和检验, 抗原特异性CD8+T细胞与总CD8+ T细胞的比较采用t检验。P<0.05为差异有统计学意义。
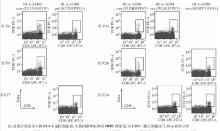
由于MHC-抗原肽四聚体与淋巴细胞有一定的非特异性结合, 因此我们通过对携带HLA-A02或HLA-24等位基因的正常人PBMC进行标记, 以CD19-细胞设门, 确定以CD8+Tetra+/CD8+≤0.01%作为HBV特异性CD8+T细胞检出的Cut-off值, 因为所有正常供者对照CD8+Tetra+/CD8+ ≤ 0.01%。在全部35例CHB患者中, 共有9例检出针对不同抗原肽抗原特异性CD8+T细胞的病例, 其CD8+Tetra+/CD8+>0.01%(0.33%~2.14%,中位数为0.95%)。见图1:
采用胞内细胞因子染色、流式细胞仪分析技术分析HBV抗原特异性CD8+T细胞IL-2和IFN-γ的分泌能力。结果显示, HBV抗原特异性CD8+T细胞IL-2和IFN-γ的分泌能力均显著低于患者自身的外周血总CD8+T细胞(P<0.01),强烈提示HBV抗原特异性CD8+T细胞存在功能缺陷, 见图2。然而, 对比检出HBV抗原特异性CD8+T细胞患者与未检出HBV抗原特异性CD8+T细胞患者的外周血总CD8+T细胞IL-2和IFN-γ的分泌能力, 差异无统计学意义(P>0.05),见图2:
外周血抗原特异性CD8+ T细胞和总CD8+ T细胞的细胞因子表达分析
对CHB患者外周血HBV抗原特异性CD8+T细胞进行初步功能分析后再对比HBV抗原特异性CD8+T细胞阳性患者与阴性患者血清ALT和外周血病毒载量 (HBV DNA) 的水平。结果显示, HBV抗原特异性CD8+T细胞阳性患者血清ALT水平明显高于阴性患者(P<0.05),HBV DNA载量则显著低于阴性患者(P<0.01),见图3。这一结果提示在HBV抗原特异性细胞阳性患者中可能存在较强的抗病毒免疫反应。
HBV感染的临床转归与机体免疫密切相关, 其中细胞免疫, 尤其是HBV特异性CTL在病毒清除过程中起着重要的作用。但是, 研究发现HBV慢性感染者体内HBV特异性CTL存在数量和质量上的缺陷, 不能有效地清除病毒。在慢性期抗病毒T细胞反应与急性期状态存在明显不同。急性感染条件下, 抗原特异性T细胞活化后, 其最终命运有2种可能, 一是成为终末分化的效应细胞, 二是成为前体记忆细胞[ 8]。然而, 在慢性感染条件下, 无论是在动物模型还是人类疾病, 抗原特异性效应T细胞功能失调都是一种普遍的现象。持续的病毒刺激造成功能耗竭是效应T细胞功能失调的重要原因[ 3]。在多项研究中已经证实, 程序性死亡蛋白1 (programmed death-1, PD-1) 和B、T淋巴细胞弱化因子 (B and T lymphocyte attenuator, BTLA) 不仅是T细胞耗竭状态的重要表面标志, 亦是导致效应T细胞耗竭的重要效应分子[ 9]。研究证实CHB患者外周血和肝内CD8+T细胞表达PD-1、BTLA (CD8+PD-1+BTLA+)的比例均显著高于正常对照组及疾病对照组, CD8+PD-1+BTLA+T细胞分泌IL-2和IFN-γ的水平显著低于CD8+PD-1-BTLA-T细胞;单独阻断或联合阻断上述分子能有效地恢复CD8+T细胞的效应功能, 包括促细胞增殖、细胞因子分泌[ 10]。本研究发现CHB患者外周血HBV抗原特异性CD8+T细胞IL-2和IFN-γ的分泌能亦显著低于患者自身的外周血总CD8+T细胞。该结果更为明确的证实了CHB感染条件下, 抗病毒T细胞效应功能存在明显的缺陷。
尽管本研究证实CHB患者HBV抗原特异性CD8+T细胞的功能存在明显缺陷, 然而HBV抗原特异性CD8+T细胞阳性患者血清ALT的水平明显高于阴性患者(P<0.05),HBV DNA载量则显著低于阴性患者(P<0.01) 。这些结果提示, HBV抗原特异性CD8+T细胞在外周血的出现, 表明这些患者体内存在较为激烈的抗病毒免疫反应, 体现为HBV抗原特异性T细胞检出阳性患者的HBV病毒载量较检出阴性患者低, 同时其肝功能活动性损伤亦较为严重。有研究显示, 急性乙型肝炎患者外周血HBV抗原特异性CD8+T细胞的检出率明显高于慢性乙型肝炎患者, HBV抗原特异性CD8+T细胞百分率高的患者血清HBV DNA和HBV e抗原的清除要早于HBV抗原特异性CD8+T细胞百分率低的患者, 表明HBV抗原特异性CD8+T细胞在病毒的清除和疾病的自限过程中起重要作用[ 11]。HBV抗原特异性CD8+T细胞究竟对CHB患者疾病的转归有何影响, 还需进行长期的随访观察。
综上所述, 本研究初步分析了CHB患者外周血抗原特异性CD8+T细胞的功能特点及与相关临床指标的关系。对于象CHB这样的慢性感染性疾病, 对病毒特异性T细胞进行功能分析, 可能不仅有助于判断疾病的进程、预测转归, 更有利于认识感染条件下免疫系统与病毒之间的相互作用, 为通过调节免疫功能, 治疗CHB等慢性感染性疾病, 甚至肿瘤等提供新的思路。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|