作者简介:赵付菊,女,1985年生,硕士,住院医师,主要从事病原微生物学与分子诊断学研究。
通讯作者:赵 虎,联系电话:021-62483180-20847。
细菌产生β-内酰胺酶引起临床抗感染治疗的失败已成为全球性的医疗保健问题,AmpC β-内酰胺酶(简称AmpC酶)是其中重要的一种,有关其诱导表达的分子机制的研究日渐更新,现就AmpC 酶染色体介导的调控机制的研究现状进行综述。
Bacterial resistance to beta-lactamase antibiotics through producing beta-lactamase has become a worldwide healthy care problem. AmpC beta-lactamase (AmpC) is a major one of beta-lactamases. Extensive research has focused on the molecular regulation mechanism pertaining to induction. The recent researches on the regulation mechanism about the expression of chromosomally-mediated AmpC are reviewed.
随着β-内酰胺类抗菌药物的广泛应用,细菌除了通过改变青霉素结合蛋白(penicillin-binding proteins,PBPs)的作用靶点、减少外膜的通透性及增加药物外排等方式对药物产生耐药外,最主要是产生β-内酰胺酶[ 1]。AmpC β-内酰胺酶(简称AmpC 酶)是其中重要的一种β-内酰胺酶,尤其染色体编码的AmpC酶的诱导过表达是革兰阴性杆菌对青霉素、头孢菌素、头霉素及单环β-内酰胺类抗菌药物产生耐药的主要机制[ 2]。由染色体突变引起AmpC酶高表达也是铜绿假单胞菌和大部分肠杆菌科细菌耐广谱β-内酰胺类药物的主要原因[ 3]。目前有关AmpC酶诱导表达的分子机制主要有2种:AmpG-AmpR-AmpC 途径和BlrA/BlrB双组分调控系统[ 4, 5]。本文主要针对前一种分子机制进行综述。
AmpC 酶是一种丝氨酸活性蛋白酶,Ambler 分子结构学分类属C类,Bush-Jacoby-Medeiros功能学分类属于I 组,相对分子质量为34 000~40 000,主要分布在细胞周质。AmpC 酶按表型可分为4类:野生型(正常的诱导类型)、温度敏感型(在不适温度下失去诱导表达能力)、高表达型(AmpC酶表达处于较高水平或在低浓度的药物诱导下高水平表达)及持续高产型(即临床高度重视的组成型高水平表达)[ 6]。常见的β-内酰胺酶抑制剂如克拉维酸、舒巴坦、他唑巴坦对AmpC酶的抑制作用不明显,氯唑西林、苯唑西林和Avibactam对其有抑制作用[ 7, 8, 9]。
AmpC酶可由染色体或质粒编码产生,染色体介导表达AmpC酶的细菌主要是肠杆菌科细菌,如阴沟肠杆菌、弗氏柠檬酸杆菌、大肠埃希菌、黏质沙雷菌、产气肠杆菌、普罗威登斯菌、小肠结肠炎耶尔森菌、蜂房哈夫尼亚菌及摩氏摩根菌,其他非肠道来源的革兰阴性菌如铜绿假单胞菌、温和气单胞菌、嗜水气单胞菌、鲍曼不动杆菌和人苍白杆菌也有表达,这些菌株间AmpC酶的结构基因—— ampC基因序列具有广泛的同源性[ 10]。 ampC基因可以从染色体转移至质粒,在不同菌种间传播,使得原本染色体 ampC基因缺失的菌株通过质粒获得产AmpC酶的能力,以肺炎克雷伯菌最为常见[ 11]。另外,大肠埃希菌在正常情况下只产生少量的AmpC酶,且不足以水解广谱头孢菌素类抗菌药物,当从其他菌属如柠檬酸杆菌属和肠杆菌属某些细菌获得持续高产AmpC酶的质粒的突变株后,其AmpC酶表达能力显著提高[ 12]。
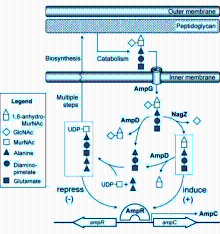
AmpC酶表达调控机制在不同菌株间特点不尽相同,作为调控机制之一的AmpG-AmpR-AmpC途径主要与细菌细胞壁的循环及调控基因 ampG、 ampD、 ampR、 ampE和 nagZ等的表达和调控有关[ 4, 5, 13]。
ampG编码生成的AmpG 是一种细胞质膜结合渗透酶,负责转运细胞壁降解产物,这些产物中1,6-无水胞壁肽被 ampD 编码产生的N-乙酰胞壁酰-L-丙氨酸酰胺酶AmpD水解生成短肽和1,6-无水胞壁酸,参与合成细胞壁前体尿苷二磷酸-N-乙酰胞壁酸酯五肽[ 11]。 nagZ基因编码生成一种细胞溶质酶NagZ,能够水解切断由AmpG转运至细胞质的肽聚糖代谢产物,将N-乙酰葡糖胺从胞壁肽上解离出来形成1,6-无水-N-乙酰胞壁酸酯和肽段,参与细胞壁的循环再利用[ 14]。 ampE和 ampD基因形成一个操作子,编码生成一种跨膜蛋白AmpE,作为 ampC表达过程中的一种传感器[ 15]。 ampR 编码生成LysR 家族的蛋白AmpR,是 ampC的转录激活因子,AmpR与尿苷二磷酸-N-乙酰胞壁酸酯五肽结合,使得AmpC 表达呈组成型低水平。
临床分离株中引起AmpC酶过表达最常见原因是 ampD突变,突变率高达10-5~10-7,引起AmpC酶高诱导或组成型高表达。 ampR 突变会引起AmpC酶发生组成型高表达,但与 ampD相比较少见[ 15]。 ampG突变则更为少见,它也能引起AmpC酶发生组成型低水平表达[ 11]。见图1[ 16]。
1.细胞壁的循环利用与AmpC酶诱导表达 细菌细胞壁主要由肽聚糖交联形成,肽聚糖也称胞壁质,是由N-乙酰葡糖胺和N-乙酰胞壁酸通过β-1,4糖苷键交替连接而成。肽聚糖是细胞壁主要结构,维持细胞的形态和渗透压。在正常的细菌生长过程中,超过50%的亲代肽聚糖参与再循环。在自溶酶的作用下,细胞壁肽聚糖分解产生一系列细胞周质的N-乙酰葡糖胺-1,6-无水-N-乙酰胞壁酸酯肽类(三肽、四肽和五肽)代谢产物[ 17],这些胞壁肽通过细胞内膜渗透酶AmpG转运至细胞质中,胞壁肽的N-乙酰氨基葡糖被氨基葡糖苷酶NagZ解离下来,1,6-无水-N-乙酰胞壁酸酯三肽/五肽则形成肽聚糖的前体尿苷二磷酸-N-乙酰胞壁酸酯五肽,1,6-无水-N-乙酰胞壁酸脂四肽不会在细胞质中蓄积,它在细胞质的L,D-羧基肽酶LdcA作用下转变成1,6-无水-N-乙酰胞壁酸脂三肽,重新循环参与细胞壁肽聚糖的循环[ 3]。
肽聚糖的合成分解代谢决定 ampC是否转录,通过代谢产物竞争性结合转录调节蛋白AmpR实现。 ampR和 ampC 基因含启动子重叠但方向不同的操纵子,AmpR结合在启动子上从而调节2个基因的转录。在无β-内酰胺抗菌药物作用时,细胞质中的1,6-无水-N-乙酰胞壁酸脂-肽受AmpD调节,将肽段转移出1,6-无水-N-乙酰胞壁酸脂糖。尿苷二磷酸-N-乙酰胞壁酸酯五肽结合到AmpR,抑制 ampC的转录。然而,在β-内酰胺抗菌药物作用下,肽聚糖的降解产物明显升高,1,6-无水-N-乙酰胞壁酸脂肽堆积,三肽或五肽置换了AmpR上的尿苷二磷酸-N-乙酰胞壁酸酯五肽,促进 ampC转录生成AmpC水解β-内酰胺抗菌药物,重建肽聚糖自我平衡,使得AmpC产生恢复到基础水平。
2. AmpG在诱导AmpC酶表达过程中的作用 AmpG为内膜渗透酶,通过将肽聚糖分解产物N-乙酰葡糖胺-1,6-无水-N-乙酰胞壁酸酯肽或无水胞壁肽由细胞周质转运入细胞质,近乎所有细胞壁的片段需通过AmpG参与胞壁循环利用,AmpG在AmpC酶诱导产生过程中起关键作用。AmpG包括10个跨膜束和2个大的胞质环状结构,为单组分的渗透酶,依赖质子动力势发挥作用[ 18]。Zamorano等[ 19]研究表明当AmpG 失活时,耐β-内酰胺药物的铜绿假单胞菌对药物的敏感性可完全恢复。 ampG在 ampC表达中起重要作用且在革兰阴性菌中高度保守,因此AmpG也可能成为抑制AmpC酶诱导产生的有效药物作用靶点。
3. NagZ在诱导AmpC 酶表达过程中的作用 NagZ是一类N-乙酰氨基葡糖苷酶,是由 nagZ编码生成的一种细胞溶质酶,能够水解切断由AmpG转运至细胞质的肽聚糖代谢产物无水二糖类物质N-乙酰葡糖胺-无水-N-乙酰胞壁酸酯胞壁肽的β-1,4糖苷键,将N-乙酰葡糖胺从胞壁肽上解离形成1,6-无水-N-乙酰胞壁酸酯和肽段,参与细胞壁的循环再利用[ 20]。NagZ 催化生成的1,6-无水-N-乙酰胞壁酰脂肽类分子可使AmpR转变成 ampC转录激活因子,是AmpC酶过表达的必备条件。因此阻断它的活性可以作为抑制 ampC表达的策略之一。有研究表明铜绿假单胞菌中NagZ失活不仅减弱由AmpC酶诱导生成引起的对β-内酰胺药物的耐药,还能使得因 ampD和 dacB突变引起耐β-内酰胺药物的突变菌株的最小抑菌浓度恢复到野生菌株水平[ 16]。因此,NagZ的小分子抑制剂可能提高广谱β-内酰胺药物的作用,降低强耐药株的出现[ 14]。
4. AmpD在诱导AmpC 酶表达过程中的作用 AmpD称N-乙酰胞壁酰-L-丙氨酸酰胺酶,是一种细胞质锌离子依赖的酰胺酶,与细菌细胞壁的循环利用和β-内酰胺酶诱导生成有关[ 21, 22]。属于酰胺酶2类家族,能够在D-乳酰基和L-丙氨酸残基间水解切断无水胞壁肽结构,从1,6-无水-N-乙酰胞壁酸酯转移出肽段,生成1,6-无水-胞壁酸和肽段,肽段进一步生成三肽,随后被参与细胞壁循环利用途径的酶类物质获取,最终形成细胞壁的前体尿苷二磷酸-N-乙酰胞壁酸酯五肽[ 23]。AmpD对无水胞壁肽的水解有高度的选择性,在无水N-乙酰胞壁酸酯三肽和尿苷二磷酸-N-乙酰胞壁酸酯五肽这2个分子上水解效率相差至少1 000倍[ 22],这种选择性确保了AmpD只参与胞壁肽的循环但不降解肽聚糖的前体。
ampD突变是引起AmpC酶高表达最常见的原因,包括点突变、平截突变和大片段插入,主要中断蛋白的羧基端[ 11, 24, 25]。AmpD 包括2个重要的结合位点:一个锌离子结合域和底物(1,6-无水胞壁肽)结合区。核磁共振结构分析弗氏柠檬酸杆菌的AmpD结构发现几个与AmpD 功能密切相关的氨基酸,锌离子结合必须的氨基酸包括164位的天冬氨酸和34、154位的组氨酸[ 11]。现有文献报道与AmpD 功能密切相关的位点还包括13、63、71、95、143、149位及AmpD蛋白羧基末端最后16个氨基酸位点,与底物结合相关的氨基酸通常是疏水的,并集中在蛋白的氨基端[ 11, 26]。不同菌株间的AmpD蛋白高度同源,因此在一个菌种中引起蛋白失活的点突变也许对其他菌株同样有害[ 26]。
5. AmpR 在诱导AmpC 酶表达过程中的作用 AmpR属于LysR 家族转录调节蛋白,大小为32 000,含有一个C 端效应分子集合区(effector-binding domain,EBD)和N端DNA结合区(LysR-type transcriptional regulators,LTTR)。AmpR 功能复杂,与细菌的耐药、毒力、环鸟苷二磷酸的水平,丝氨酸、苏氨酸和酪氨酸磷酸化,氧化应激及热休克过程等有关[ 24]。AmpR诱导AmpC 酶表达作用依赖于细胞质内细胞壁降解产物和胞壁质前体的水平。AmpR作为 ampC的转录激活因子,其失活导致 ampC不能诱导表达。细胞壁循环代谢产物1,6-无水-N-乙酰胞壁酸脂三肽和五肽与AmpR结合诱导 ampC转录,细胞壁前体尿苷二磷酸-N-乙酰胞壁酸酯五肽是 AmpR的辅阻遏物,抑制 ampC转录。 ampR和 ampC基因含一个启动子重叠转录方向不同的操纵子,AmpR调控2个基因的转录。AmpR的效应分子结合域晶体结构是二聚物,有2个子域,效应分子结合在2个子域间的小囊内,位于域间的小囊所对应的氨基酸的替换如Thr103Val、Ser221Ala和Tyr264Phe能够解除AmpR激活 ampC的转录能力[ 13]。有研究表明AmpR构象改变是其发挥去阻遏作用必备条件。基于AmpC酶诱导表达途径最终要汇集在转录调节因子AmpR上。因此,设计一些能够阻断无水-N-乙酰胞壁酸脂三肽/五肽与AmpR结合或至少预防避免能够激活 ampC转录所必须的AmpR的构象改变的小分子,可以有效控制AmpC酶的过表达[ 27]。
6. β-内酰胺药物与AmpC酶的诱导表达 β-内酰胺类药物对AmpC酶诱导表达能力不尽相同,青霉素、氨苄西林、阿莫西林和头孢菌素类药物如头孢唑啉和头孢菌素是AmpC酶表达的强诱导剂,也是酶很好的底物。头孢西丁和亚胺培南对AmpC酶的表达也有很强的诱导作用,但不易被酶水解。头孢噻肟、头孢曲松、头孢他啶、头孢吡肟、头孢呋辛、哌拉西林和氨曲南对AmpC酶诱导表达作用较弱,也不容易被水解,能否被水解取决于酶的表达量是否充足[ 7]。β-内酰胺酶抑制剂对AmpC酶的表达同样有诱导作用,以克拉维酸最为典型,它对AmpC酶活性的抑制作用很弱,但能明显诱导AmpC酶的表达[ 9]。
故此,临床上治疗AmpC酶相关的感染,选择抗菌药物时要综合考虑药物对AmpC 酶的诱导作用及酶对药物的水解能力。以治疗铜绿假单胞菌为例,虽碳青霉烯类药物是AmpC酶的强诱导剂,但因AmpC酶对其水解作用极弱,治疗上仍很有效,然而细菌若出现膜孔蛋白OprD的缺失或减少,发生与AmpC酶协同作用,则会引起碳青霉烯类药物治疗的失败,肠杆菌科中也会出现染色体AmpC酶过表达伴发孔蛋白的抑制或失活引起碳青霉烯类药物发生低水平的耐药[ 27]。
综上所述,AmpC 酶是多数肠杆菌科细菌及铜绿假单胞菌属细菌等对头孢菌素、头霉素类、绝大数青霉素及含酶抑制剂的青霉素复方制剂等抗菌药物产生耐药的主要原因,其表达受多种因素的影响,尤其是以 ampD、 ampR为主的调控基因的突变能够引起染色体介导的AmpC酶持续高表达,临床危害更大。不同β-内酰胺药物对AmpC酶诱导能力不全相同,因此,对AmpC酶调控机制的深入研究,为临床合理选择抗菌药物,预防和控制AmpC酶引发的抗感染治疗失败有重要的理论意义,也为新药的研发提供新思路。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|