引用本文
邵维杰, 陆银华, 张健, 朱岭峰, 朱宇清, 蒋玲丽, 肖艳群, 简敏华, 陈慧英. 动物血清替代人血清制备乙肝标志物室间质评物的初步研究. 2014, 29(10): 1045-1048[SHAO Weijie, LU Yinhua, ZHANG Jian, ZHU Lingfeng, ZHU Yuqing, JIANG Lingli, XIAO Yanqun, JIAN Minhua, CHEN Huiying.. Primary research on a hepatitis B virus marker external quality assessment material being prepared by animal serum instead of human serum.
Labratory Medicine , 2014, 29(10): 1045-1048]
Permissions
Copyright©2014, 《检验医学》编辑部
《检验医学》编辑部
动物血清替代人血清制备乙肝标志物室间质评物的初步研究
邵维杰, 陆银华, 张健, 朱岭峰, 朱宇清, 蒋玲丽, 肖艳群, 简敏华, 陈慧英
作者简介:邵维杰,男,1955年生,主管技师,主要从事临床免疫学检验和临床免疫学质量控制研究。
基金:上海市卫计委科研课题资助(2009192) ;
摘要
目的 尝试制备以胎牛血清(FCS)替代人血清为基质的乙型肝炎病毒(HBV)标志物室间质评样本。
方法 以FCS作为基质稀释人血清HBV标志物高值样本制备室间质评样本,并对制备样本进行基质效应和互换性实验、均匀性和稳定性评估及初步临床应用。
结果 使用两种检测方法验证制备样本的可互换性,检测值分布于95%可信区间内,相关性很好。雅培i1000全自动免疫分析仪检测HBV 5个项目[乙型肝炎病毒表面抗原(HBsAg)、乙型肝炎病毒表面抗体(HBsAb)、乙型肝炎病毒e抗原(HBeAg)、乙型肝炎病毒e抗体(HBeAb)、乙型肝炎病毒核心抗体(HBcAb)]制备物结果的F 值均界值(F 界值=3.02),保存于-20 ℃和4 ℃时可稳定1个月以上。20家使用化学发光法[ABBOTT i2000全自动免疫分析仪(简称ABBOTT i2000)]和20家使用酶免法(科华试剂)的实验室HBsAg、HBsAb、HBeAg、HBeAb、HBcAb的变异系数(CV )分别为ABBOTT i2000仪器组7.60%、7.79%、6.37%、13.30%、3.61%,科华试剂组11.67%、14.72%、9.11%、12.30%、9.75%。
结论 通过试验验证以FCS为基质制备的质评样本的互换性、稳定性和均匀性满足室间质评样本要求,初步认为FCS在一定程度上可以作为基质用于HBV标志物室间质评样本的制备。
关键词 :
乙型肝炎病毒 ; 标志物 ; 室间质评物 ; 动物血清 ; 基质效应 ; 均匀性和稳定性
中图分类号:R446.1
文献标志码:A
文章编号:1673-8640(2014)10-1045-04
Primary research on a hepatitis B virus marker external quality assessment material being prepared by animal serum instead of human serum
SHAO Weijie, LU Yinhua, ZHANG Jian, ZHU Lingfeng, ZHU Yuqing, JIANG Lingli, XIAO Yanqun, JIAN Minhua, CHEN Huiying.
Shanghai Center for Clinical Laboratory, Shanghai 200126, China
Abstract
Objective To try to use fetal calf serum (FCS) to prepare hepatitis B virus (HBV) marker external quality assessment material instead of human serum.
Methods FCS was used as matrix, and human serum high-level HBV marker external quality assessment material was diluted. The matrix efficiency, interchangeability, homogeneity, stability and clinical application significance were evaluated.
Results For the interchangeability of the 2 determination methods, the results were within 95% confidence interval, and the correlation was good.F values were all F (3.02) by Abbott i1000 for 5 HBV parameters [hepatitis B surface antigen (HBsAg), anti-hepatitis B surface antigen antibody (HBsAb), hepatitis B e antigen (HBeAg), anti-hepatitis B e antigen antibody (HBeAb) and anti-hepatitis B core antigen antibody (HBcAb)]. The stability was good above 1 month when storing under -20℃ and 4 ℃. The coefficients of variation (CV ) for HBsAg, HBsAb, HBeAg, HBeAb and HBcAb were 7.60%, 7.79%, 6.37%, 13.30% and 3.61% by 20 laboratories using Abbott i2000, and were 11.67%, 14.72%, 9.11%, 12.30% and 9.75% by 20 laboratories using KHB reagents.
Conclusions When using FCS as matrix, the interchangeability, homogeneity and stability meet the requirements of external quality assessment, and FCS can be used as matrix for the preparation of HBV marker external quality assessment material primarily.
Keyword :
Hepatitis B virus ; Marker ; External quality assessment material ; Animal serum ; Matrix efficiency ; Homogeneity and stability
实验室室间质量评价是临床实验室全面质量管理的重要部分,其有助于提高临床检验质量水平[ 1 。随着检验医学的发展,临床实验室对室间质评活动中开展的项目不断的扩项,目前仅上海市临床检验中心临床免疫专业开展的项目已达12大项,近90小项,其中乙型肝炎病毒(HBV)标志物项目是开展时间最长,参加的实验室最多(地区性的就有数百家)的临床免疫学项目之一。室间质评活动需要使用大量的质评样本,以人血清为基质的样本制备会受到临床用血需求的影响,使室间质评活动组织者难以提供较大量的以人血清为基质制备的质评样本[ 2 。为此,我们尝试以胎牛血清(FCS)替代人源血清制备成HBV标志物的质评样本,并对此样本的基质效应、均一性和稳定性进行了评估。
材料和方法 一、材料 1.血清样本 来源于医院实验室新鲜HBV各种模式的血清样本,冰冻保存。
2.新鲜胎牛血清 浙江天杭生物公司
3.检测仪器和试剂 雅培ARCHITECT i1000sr全自动免疫分析仪(简称ABBOTT i1000sr),罗氏COBAS e411电化学发光分析仪(简称ROCHE e411)。乙型肝炎病毒表面抗原(HBsAg)、乙型肝炎病毒表面抗体(HBsAb)、乙型肝炎病毒e抗原(HBeAg)、乙型肝炎病毒e抗体(HBeAb)和乙型肝炎病毒核心抗体(HBcAb)试剂均为各仪器配套试剂。
二、方法 1.室间质评物的制备 取HBV标志物强阳性血清(即HBsAg、HBsAb、HBeAg、HBeAb和HBcAb均高含量)灭活后,以新鲜FCS稀释配成低浓度至中、高浓度的HBV标志物阳性血清,加入适量的防腐剂和稳定剂后,进行无菌过滤并分装于塑料小样本管内,保存于-20 ℃、4 ℃和20 ℃。
2.基质效应和互通性评估实验 按照基质效应与互通性评估指南文件(WS/T 356—2011)[ 3 ,将制备的样本与20份新鲜的临床样本随机穿插排列,分别用ABBOTT i1000sr、ROCHE e411测定所有样本,重复测定3批次。检测项目为HBsAg、HBsAb、HBeAg、HBeAb和HBcAb。
3.均匀性和稳定性评价实验[ 4 (1)均匀性实验:从本研究的各个项目制备物中各随机抽取10个样本,采用ABBOTT i1000sr重复测试2次,检测项目为HBsAg、HBsAb、HBeAg、HBeAb和抗HbcAb;(2)稳定性实验:在第1、4、7、14、30天从保存于-20 ℃、4 ℃和20 ℃的样本中各取出3个样本,采用ABBOTT i1000sr重复检测HBsAg、HBsAb、HBeAg、HBeAb、HBcAb各2次。
4.室间质评物的初步临床应用 选取40家临床免疫实验室,其中20家使用化学发光法[雅培i2000全自动免疫分析仪(简称ABBOTT i2000)],20家使用酶免法(科华试剂),对制备的PT样本检测HBV 5项。
三、数据分析和评估[ 3 4 1.基质效应和互通性评估 采用线性回归分析法。
2.均匀性检验 单因子方差分析。
3.稳定性检验 t 检验法。
四、初步临床使用 选取本市在以往参加室间质评结果符合率高的40家实验室,其中20家使用Abbott i2000和20家使用酶免法(科华试剂)的实验室,同时通过由冷链送达的五个阳性样本和一个全阴性样本,进行HBsAg、HBsAb、HBeAg、HBeAb、HBcAb项目检测,检验方法之间的一致性,并与其常规室间质评活动中相应仪器实际组的样本数据进行比较。
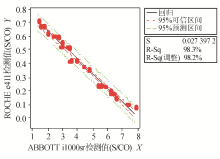
结 果 一、基质效应和互通性实验结果
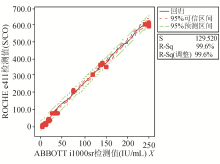
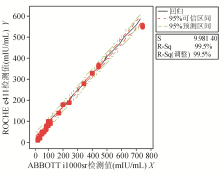
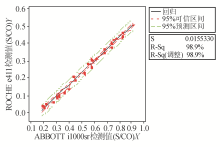
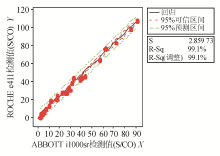
以ABBOTT i1000检测值为 X 轴,ROCHE e411检测值为 Y 轴作图,线性回归分析结果为HBsAg Y= 26 . 18 + 25 . 26 X , R 2 = 99.6%;HBsAb Y= 8 . 45 + 0 . 72 X , R 2 = 99.5%;HBeAg Y= 0 . 98 + 1 . 14 X , R 2 = 99.1%;HBeAb Y=- 0 . 12 + 0 . 68 X , R 2 = 98.9%;HBcAb Y= 0 . 85 - 0 . 11 X , R 2 = 98.2%。且两种方法对于制备物的检测值全位于95%可信区间内,则结果无基质效应。
二、均匀性评估 采用单因子方差分析ABBOTT i1000sr检测HBV 5个项目各2个浓度制备物的结果。结果显示各测定 F 值均 <F 界值( F 界值=3.02)。测定 F 值 <F 界值为符合,见表1 。制备物的均匀性评估符合要求。
表1
表1
表1 HBsAg、HBsAb、HBeAg、HBeAb、HBcAb均匀性统计结果 样本 HbsAg HbsAb HbeAg HBeAb HBcAb 均值 0.89 21.70 0.32 0.44 2.16 标准差 0.04 0.572 0.024 0.033 0.10 F 值0.587 1.386 1.22 1.09 1.01 均匀性 符合 符合 符合 符合 符合
表1 HBsAg、HBsAb、HBeAg、HBeAb、HBcAb均匀性统计结果
三、稳定性实验结果 取出保存于-20 ℃、4 ℃和20 ℃条件下的制备物,分别于第1、4、7、15天和第30天用ABBOTT i1000sr检测。 t 检验结果显示,保存于-20 ℃和4 ℃的制备物能稳定一个月以上,在20 ℃时能稳定4 d。见表2 。
表2
表2
表2 HBsAg、HBsAb、HBeAg、HBeAb和HBcAb稳定性结果 项目 统计值 -20 ℃ 4 ℃ 20 ℃ 1 4 7 15 30 4 7 15 30 4 7 HBsAg 均值 0.89 0.87 0.89 0.89 0.87 0.87 0.91 0.92 0.87 0.91 0.86 t 值1.03 0.38 0.36 1.40 1.05 0.70 1.09 1.32 0.05 2.62 判断 稳定 稳定 稳定 稳定 稳定 稳定 稳定 稳定 稳定 不稳 HBsAb 均值 21.78 21.84 21.92 22.09 21.37 21.96 21.42 21.46 21.45 21.44 21.09 t 值0.19 0.29 1.04 0.55 0.57 1.21 1.06 1.12 1.07 2.34 判断 稳定 稳定 稳定 稳定 稳定 稳定 稳定 稳定 稳定 不稳 HBeAg 均值 28.29 27.81 28.58 28.45 28.52 28.64 28.34 28.56 28.45 27.92 27.77 t 值1.61 1.64 0.90 0.76 1.81 0.20 1.01 0.59 1.50 2.76 判断 稳定 稳定 稳定 稳定 稳定 稳定 稳定 稳定 稳定 不稳 HBeAb 均值 0.45 0.47 0.47 0.47 0.46 0.46 0.47 0.47 0.43 0.43 0.42 t 值1.05 0.69 1.15 0.61 0.67 0.84 0.75 1.35 1.25 2.65 判断 稳定 稳定 稳定 稳定 稳定 稳定 稳定 稳定 稳定 不稳 HBcAb 均值 10.18 10.33 10.31 10.25 10.06 10.31 10.31 10.26 10.01 10.06 9.81 t 值0.85 1.04 0.53 0.79 0.82 0.71 0.50 1.01 0.73 2.61 判断 稳定 稳定 稳定 稳定 稳定 稳定 稳定 稳定 稳定 不稳
注: t 检验查表界值为 t (6+6-2)=2.228,故认为检测 t 值<2.228为稳定,反之为不稳定(简称不稳)
表2 HBsAg、HBsAb、HBeAg、HBeAb和HBcAb稳定性结果
四、初步应用 1. HBV 5项预测值为阴性的样本采用ABBOTT i2000和酶免法检测均为阴性。
2.预测值为阳性的5个项目样本分别采用ABBOTT i2000(20家实验室)和酶免法(20家实验室)进行检测,并将检测结果与本地区一次HBV室间质评活动中ABBOTT i2000仪器组(60家)和科华试剂组(70家)的检测结果进行比较,见表3 、表4 。结果显示本HBV室间质评样本基本符合于地区性室间质评要求。
表3
表3
表3 家ABBOTT i2000检测结果与ABBOTT i2000仪器组室间质评结果的比较 项目 HBsAg(IU/mL) HBsAb(mIU/mL) HBeAg(S/CO) HBeAb(S/CO) HBcAb(S/CO) 本样本 室间 本样本 室间 本样本 室间 本样本 室间 本样本 室间 均值 1.02 0.31 33.34 32.92 28.40 28.33 0.045 0.050 5.87 4.30 s 0.076 0.02 2.63 2.87 1.81 2.01 0.006 0.005 0.21 0.35 CV (%)7.60 7.92 7.79 8.72 6.37 7.07 13.30 10.78 3.61 8.11
注:本样本为ABBOTT i2000检测结果;室间为ABBOTT i2000仪器组室间质评结果
表3 家ABBOTT i2000检测结果与ABBOTT i2000仪器组室间质评结果的比较
表4
表4
表4 酶免法检测结果与科华试剂组室间质评结果的比较 项目 HBsAg(IU/mL) HBsAb(mIU/mL) HBeAg(S/CO) HBeAb(S/CO) HBcAb(S/CO) 本样本 室间 本样本 室间 本样本 室间 本样本 室间 本样本 室间 均值 7.93 2.81 5.23 4.93 11.85 12.76 0.423 0.356 0.41 0.151 s 0.88 0.75 0.77 1.44 1.08 3.98 0.052 0.13 0.04 0.098 CV (%)11.67 26.51 14.72 29.17 9.11 31.19 12.30 36.57 9.75 64.62
注:本样本为酶免法检测结果;室间为科华试剂组室间质评结果
表4 酶免法检测结果与科华试剂组室间质评结果的比较
讨 论 HBV标志物质评样本是临床免疫实验室开展室间质评活动不可或缺的物质,以往活动组织者往往是用非临床可用的各种HBV标志物模式的人源血浆(清)经过适当地处理,制备而成质评物给参与单位使用。但若干年以来,由于诸多原因此类血源非常难得到,大量的血源处理时对于实验室生物安全也是很大的危害,这将明显影响到这项质评活动的顺利开展,尽管现在有商品化质评物供应,但进口产品很贵,国产的也不知能否保证来源。为此,我们尝试采用FCS作为基质加入少量已灭活的高值HBV阳性血清,制备成质评样本,经过对该样本基质效应和互换性实验;均匀性、稳定性评估和初步的临床应用。通过用新鲜(冰冻)人血清和制备物同时检测,制备物的检测值全分布于95%可信区间内,认为结果无基质效应。5个项目的测定 F 值均 <F 界值(3.02),因此均匀性符合要求。稳定性观察显示制备物保存于-20 ℃和4 ℃时稳定性在一个月以上,在20 ℃时可稳定4 d。初步的临床应用反馈的结果显示本HBV室间质评样本基本符合于地区性室间质评要求。
临床免疫学实验室中HBV标志物检测是相当重要的项目,开展非常普及,质控品用量相当多,我们尝试以FCS作为基质制备室间质评物,如果能应用于地区性质评活动,可以节省大量的人血清(浆),也可以为制备其他定性的免疫项目的质评物提供一些思路。
The authors have declared that no competing interests exist.
参考文献
[1]
叶应妩 , 王毓三 , 申子瑜 . 全国临床检验操作规程 第3版. 南京 : 东南大学出版社 , 2006 : 99 -101 . [本文引用:1]
[2]
国家质量监督检验检疫总局 . 医学实验室能力验证的应用 GB/T 27409 -20102010 . [本文引用:1]
[3]
中华人民共和国卫生部 . 基质效应与互通性评估指南 WS/T 356 , 2011 . [本文引用:2]
[4]
中国合格评定国家认可委员会 . 能力验证样品均匀性和稳定性评价指南 CNAS GL03 , 2006 . [本文引用:2]
1
2006
0.0
0.0
... 实验室室间质量评价是临床实验室全面质量管理的重要部分,其有助于提高临床检验质量水平[1 ] ...
1
0.0
0.0
... 室间质评活动需要使用大量的质评样本,以人血清为基质的样本制备会受到临床用血需求的影响,使室间质评活动组织者难以提供较大量的以人血清为基质制备的质评样本[2 ] ...
2
0.0
0.0
... 基质效应和互通性评估实验 按照基质效应与互通性评估指南文件(WS/T 356—2011)[3 ] ,将制备的样本与20份新鲜的临床样本随机穿插排列,分别用ABBOTT i1000sr、ROCHE e411测定所有样本,重复测定3批次 ...
... 三、数据分析和评估[3 ,4 ] 1 ...
2
0.0
0.0
... 均匀性和稳定性评价实验[4 ] (1)均匀性实验:从本研究的各个项目制备物中各随机抽取10个样本,采用ABBOTT i1000sr重复测试2次,检测项目为HBsAg、HBsAb、HBeAg、HBeAb和抗HbcAb ...
... 三、数据分析和评估[3 ,4 ] 1 ...