陈洁,女,1973年生,博士,副主任技师,主要从事肿瘤糖生物学研究。
高春芳, 联系电话:021-81875131。
研究轻链型多发性骨髓瘤(LCMM)的血清N-糖谱特点及临床意义。
方法采用DNA测序仪辅助的荧光糖电泳(DSA-FACE)对年龄和性别匹配的LCMM、IgG型多发性骨髓瘤(MM)患者和健康对照者的血清N-糖谱及其他实验室检查结果进行回顾性分析。
结果LCMM患者与健康对照者血清N-糖谱比较,Peak3(单半乳糖-α-1,6-核心岩藻糖基化二天线结构,NG1A2F)和Peak6(双半乳糖-α-1,6-核心岩藻糖基化二天线结构,NA2F)显著下降,而Peak5(双半乳糖二天线结构,NA2)显著升高;采用Peak3来验证其诊断效力,Peak3诊断LCMM的受试者工作特征(ROC)曲线下面积为0.943,最佳分界点5.15%对应的敏感性和特异性分别为88.1%和90.5%。LCMM与IgG型MM患者血清N-糖谱比较,Peak3和Peak6显著下降,Peak5显著升高;采用Peak3来验证其鉴别诊断效力,Peak3鉴别诊断LCMM的ROC曲线下面积为0.895,最佳分界点6.77%对应的敏感性和特异性分别为100.0%和78.6%。将3组N-糖谱结果与临床实验室指标进行相关性分析,Peak3的改变与血清IgG、总蛋白、M蛋白峰和血轻链比值的变化呈正相关,与白蛋白、血红蛋白和血小板的变化呈负相关;但Peak5的改变正好相反;Peak6与尿素、肌酐的变化呈负相关。
结论LCMM患者的血清N-糖谱有特征性改变,尤其是Peak3的改变与患者的低球蛋白血症、肾功能损害和病情的进展程度息息相关,有望成为新型的诊断和鉴别诊断LCMM的指标。而在LCMM的预后评价和监测中,N-糖谱的检测可以减少患者多次抽骨髓造成的身体伤害,并避免由于轻链多聚体的出现和肾功能的改变造成血清和尿中轻链检测的偏差。
To investigate the characteristic and clinical significance of serum N-glycan profile in light chain multiple myeloma(LCMM).
MethodsA retrospective analysis of serum N-glycan profile was performed in LCMM patients, IgG multiple myeloma(MM) patients and healthy controls with matched sex amd age by DNA sequence-assisted, fluorophore-assisted carbohydrate electrophoresis (DSA-FACE).
ResultsPeak3 (single agalacto,core-alpha-1,6-fucosylated biantennary, NG1A2F) and Peak6(bigalacto, core-alpha-1,6-fucosylated biantennary, NA2F) in LCMM patients were significantly lower than those in healthy controls, while Peak5 (bigalacto, biantennary, NA2) was significantly higher. Using Peak 3 to verify the diagnosis efficiency, the area under the receiver operating characteristic (ROC) curve of Peak3 was 0.943. The optimum diagnosis cut-off value was 5.15% with sensitivity 88.1% and specificity 90.5%. The decrease of Peak3 and Peak6 and the increase of Peak5 were found in LCMM patients, as compared with IgG MM patients. Using Peak3 to verify the differential diagnosis efficiency, the area under the ROC curve of Peak3 was 0.895. The optimum differential diagnosis cut-off value was 6.77% with sensitivity 100.0% and specificity 78.6%. The changes of Peak3, contrary to Peak5, were positively correlated with IgG, total protein, M-spike and serum light chain ratio, and were negatively correlated with albumin, hemoglobin and platelet in the correlation analysis between serum N-glycan profile and routine laboratory parameters in the 3 groups, and the changes of Peak 6 were negatively correlated with urea and creatinine.
ConclusionsThe characteristic change has taken place in the serum N-glycan profile of LCMM patients, especially Peak3, which is closely bound on the symptoms of hypoglobulinemia, kidney function injury and the progression of disease. Meanwhile, Peak3 may become a new biomarker for diagnosing and differentially diagnosing LCMM. During the prognosis evaluation and monitoring of LCMM, the determination of N-glycan profile avoids the hurt of drawing bone marrow and eliminates the detecting errors caused by polymers of light chain and kidney malfunction on the determination of serum and urine light chains.
多发性骨髓瘤(multiple myeloma, MM)是一种恶性浆细胞增殖性疾病,在血液系统的恶性肿瘤中约占10%[
选择42例2010年4月至2012年1月在上海长征医院血液科住院并已确诊为LCMM患者血清、尿液样本(κ 19例、λ 23例),按照年龄、性别和ISS分期匹配的原则,另分别选择42名IgG型MM(κ 20例、λ 22例)和42名健康体检人员的血清、尿液样本作为对照。入选的MM患者接受萨力多胺-地塞米松、马法兰-强的松龙、万珂-萨力多胺-地塞米松-环磷酰胺、雷利度胺-地塞米松等常规化疗方案治疗,同时排除患者伴有感染性疾病。取血液和尿液样本3 mL,1 370× g离心10 min,吸取血清和上层清澈的尿液,-80 ℃保存备用。
1. 试剂
N-肽-糖苷酶F(peptide-N-glycosidase-F, PNGaseF)、10% NP40购自New England Biolabs 公司;荧光标记染料8-氨基芘-1,3,6-三磺酸三钠盐(8-amino-1,3,6-pyrenetrisulfonic acid, APTS)和寡糖标准品购自Invitrogen 公司;唾液酸酶(arthrobacter ureafaciens sialidase)购自Roche公司;氰基硼氢化钠(NaBH3CN)购自Acros公司;碳酸氢铵(NH4HCO3)、乙酸钠(NaAc)、乙酸铵(NH4AC)、柠檬酸(citric acid)等分析纯化学试剂购自国药集团化学试剂有限公司;二甲亚砜(dimethylsulfoxide, DMSO)购自上海生工有限公司。
2. 仪器
低温高速离心机5702R(德国Eppendorf);涡旋振荡器XW-80A(成都市生科仪器有限公司);遗传分析仪3500(美国应用生物系统公司ABI);电子分析天平AE-240(上海天普分析仪器有限公司);干式恒温器K30B(杭州奥盛仪器有限公司);微量移液器(法国Gilson公司);XZ-2100D血球分析仪(日本Sysmex公司);ADVIA 2400全自动生化分析仪(德国SIEMENS公司);BNP特定蛋白分析仪(德国SIEMENS公司);HYDRASYS2电泳分析仪(法国Sebia公司)。
1. 实验室指标检测
血红蛋白、血小板采用XZ-2100D血液分析仪检测;总蛋白、白蛋白、尿素、肌酐采用ADVIA 2400全自动生化分析仪检测;血清、尿液IgG和轻链比值测定使用BNP特定蛋白分析仪;血清蛋白电泳和免疫固定电泳使用HYDRASYS2电泳分析仪。
2. 血清N-糖谱检测
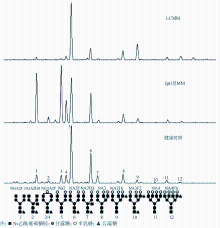
采用DNA测序仪辅助的荧光糖电泳(DNA sequencer-assisted, fluorophore-assisted carbohydrate electrophoresis,DSA-FACE)进行血清N-糖谱检测,即基于DNA测序仪的荧光糖电泳,是一种以毛细管凝胶电泳分离糖蛋白中释放出的完整寡糖的技术。其测定过程主要包括以下4个步骤:取2 μL血清,用特异的PNGaseF释放糖蛋白中与天冬酰胺连接的N-连接寡糖;干燥后以荧光素APTS标记寡糖;唾液酸酶除去寡糖末端的唾液酸;然后在遗传分析仪3500上进行毛细管凝胶电泳片段分析,数据经GeneMapper软件分析。经由上述过程处理,每份血清样本均可测得至少12个峰的糖组图谱,峰值量化,最终采用标准化的峰值数据。
应用SPSS 16.0软件对研究数据进行统计分析,对于正态分布的各指标用 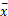
通常在血清中出现12个N-糖的峰,每个峰所代表的糖链结构已有报道[
每组的峰值及其统计学分析见表1:
| 表1 LCMM、IgG型MM患者和健康对照者的N-糖谱峰值分析 |
注:*表示指标符合正态分布,以 ±s表示,其余数据均用中位数(QR)表示
其中峰值为标准化的峰值,即每个峰的绝对高度值与12个峰值和的比值。 LCMM组与健康对照组比较,血清N-糖谱中Peak2、Peak3、Peak4、Peak6和Peak7显著下降,而Peak5、Peak8、Peak9、Peak10、Peak11和Peak12则显著升高;LCMM组与IgG型MM组比较,血清N-糖谱中Peak1、Peak3、Peak4和Peak6显著下降,而Peak5、Peak8、Peak9、Peak10、Peak11和Peak12则显著升高。
LCMM组血清N-糖谱与健康对照组和IgG型MM组比较,其中多个峰值出现了特征性的改变,对所有入选样本的血清N-糖谱与临床实验室指标进行了相关性分析,Peak5的改变与血清IgG、总蛋白、M蛋白峰和血轻链比值的变化呈负相关,而与白蛋白、血红蛋白和血小板的变化呈正相关;但Peak6的改变与尿素、肌酐的变化呈负相关,而与血清IgG、总蛋白、M蛋白峰的变化呈正相关;Peak3的变化与血红蛋白、血小板、白蛋白和尿素的变化呈负相关,而与血清IgG、总蛋白、M蛋白峰、尿IgG和血轻链比值呈正相关。见表2:
| 表2 N-糖谱与临床实验室指标的相关性分析[ r值( P值)] |
注:*代表血清蛋白电泳M蛋白峰占总蛋白的百分比;**代表血尿中kappa与lambda轻链的比值, kappa型MM为kappa/lambda;lambda型MM为lambda/kappa
1. LCMM血清N-糖谱的诊断效力评估
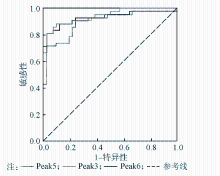
以42例LCMM患者和42名健康对照者作为研究对象,评估血清N-糖谱中Peak3、Peak5和Peak6的诊断效力,利用ROC曲线来判断,以曲线下面积表示,见图2:
在区分LCMM和健康对照中,Peak3的诊断效力最高,其ROC曲线下面积达0.943,Peak5和Peak6的诊断效力略低,分别为0.896和0.930。各N-糖标志物对LCMM的诊断结果评估见表3:
| 表3 N-糖谱对LCMM的诊断结果评估 |
Peak3和Peak6的诊断效果相当,分界点所对应的最大约登指数均为0.786;Peak5的诊断效力略低,分界点对应的最大约登指数为0.690。
2. LCMM血清N-糖谱的鉴别诊断效力评估
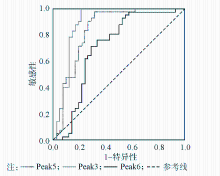
以42例LCMM患者和42例IgG型MM患者作为研究对象,评估血清N-糖谱中Peak3、Peak5和Peak6的鉴别诊断效力,利用ROC曲线来判断,以曲线下面积表示,见图3:
在鉴别诊断LCMM和IgG型MM时,Peak3的诊断效力最高,其ROC曲线下面积达0.895,Peak5和Peak6的诊断效力略低,分别为0.842和0.710。各N-糖标志物对LCMM的鉴别诊断结果评估见表4:
| 表4 N-糖谱对LCMM的鉴别诊断结果评估(与IgG型MM鉴别) |
Peak3的鉴别诊断效果最优(与IgG型MM鉴别),分界点所对应的最大约登指数为0.786;Peak5和Peak6的鉴别诊断效力略低,分界点对应的最大约登指数分别为0.666和0.429。
四、N-糖谱的诊断价值在LCMM随访样本中的验证
随访了2例κ型MM患者Peak3、Peak5和Peak6的变化情况,疾病缓解前后Peak3(%)从2.84升至3.12,Peak5(%)从52.6降至50.4,而Peak6(%)从13.4升至15.5。
LCMM的特点是血或尿中出现一类过量分泌的免疫球蛋白轻链,临床诊断常用的初筛试验是血清蛋白电泳(serum protein electrophoresis, SPE),由于轻链的相对分子质量小(22 500),其泳动迁移率会比完整的免疫球蛋白快,条带可能出现在β或α2区带,而不是免疫球蛋白通常所在的γ区带,容易在结果判断上出现混淆;此外,这类患者的总蛋白尤其是免疫球蛋白的水平下降,临床上容易并发感染,使其轻链产生的M蛋白带染色较浅。陈耐飞等[
血清、尿液轻链和近年来兴起的血清、尿液游离轻链测定也是常规的LCMM检测手段。尿液并不是理想的检测介质,因为尿液中游离轻链的分泌受到肾小管重吸收作用的影响,有研究表明正常浆细胞每天产生0.5~1 g游离轻链,而与其相比肾脏每天可代谢10~30 g游离轻链,因此只有游离轻链大量分泌超过肾小管的重吸收负荷,才能在尿中检测到[
本研究从LCMM的糖生物学出发,主要探讨血清中糖蛋白N-糖谱的特征性改变,采用了DSA-FACE的检测技术,该技术平台首先是Callewaert等[
本研究显示,在诊断性试验中LCMM患者N-糖谱Peak3、Peak5和Peak6 3个峰的改变最具代表性,其中Peak5与健康对照组相比明显升高,Peak3和Peak6则明显降低;对Peak3、Peak5和Peak6进行诊断性试验的效力评估后发现,Peak3的ROC曲线下面积最大,为0.943,其敏感性、特异性和准确性分别为88.1%、90.5%和89.3%,其诊断效力远高于常规使用的SPE和IFE。
在鉴别诊断性试验中,LCMM患者N-糖谱中同样是Peak3、Peak5和Peak6 3个峰的改变最明显,Peak3和Peak6与IgG型MM患者相比明显降低,Peak5则明显升高;对Peak3、Peak5和Peak6进行鉴别诊断性试验的效力评估后发现,Peak3的ROC曲线下面积最大,为0.895,其敏感性、特异性和准确度分别为100.0%、78.6%和89.3%。
3组血清样本的N-糖谱与临床实验室指标的相关性研究中,Peak5的改变与血清IgG、总蛋白、M蛋白峰和血轻链比值的变化呈负相关,而与白蛋白、血红蛋白和血小板的变化呈正相关;但Peak6的改变与尿素、肌酐的变化呈负相关,而与血清IgG、总蛋白、M蛋白峰的变化呈负相关;Peak3的变化与血红蛋白、血小板、白蛋白和尿素的变化呈负相关,而与血清IgG、总蛋白、M蛋白峰、尿IgG和血轻链比值呈正相关。可见LCMM患者血清N-糖谱的变化与低球蛋白血症(尤其是IgG)、肾功能损害和病情的进展关系密切;而LCMM血清N-糖谱与血红蛋白和血小板的变化呈负相关,可能由于治疗中使用了促红细胞生成素等相关药物;同时LCMM患者血清N-糖谱与IgG型MM患者相比,SPE中M蛋白峰和血轻链比值的变化不显著,这可能也是造成这些检测指标在LCMM中诊断效果不佳的原因之一。
因此,血清N-糖谱作为一项新型且操作便捷的检测标志物,有望给LCMM的诊断、监测和预后判断上提供新的辅助诊断手段。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|