张健,男,1970年生,博士,副主任技师,主要从事免疫学检验和实验室质量控制工作。
建立测定人血清广泛型线粒体肌酸激酶(uMtCK)浓度的双抗体夹心酶联免疫吸附试验(ELISA)。
方法应用原核表达的uMtCK重组蛋白免疫小鼠获得7株单克隆抗体,采用棋盘格滴定法筛选出最佳双抗体组合,其中抗体19F11进行辣根过氧化物酶(HRP)标记作为检测抗体,抗体3C1作为俘获抗体,建立检测人uMtCK双抗体夹心ELISA方法,并进行方法学评价。同时采用该法检测50名健康体检者和85例肿瘤标志物[甲胎蛋白(AFP)或癌胚抗原(CEA)]阳性患者的血清。
结果通过筛查获得配对抗体,建立检测人uMtCK的双抗体夹心ELISA方法。该法的检测限为28.8 ng/mL,批内变异系数(
建立的双抗体夹心ELISA可以用于测定人血清uMtCK浓度。
To establish double antibody sandwich enzyme-linked immunosorbent assay (ELISA) for the determination of ubiquitous mitochondrial creatine kinase(uMtCK) in human serum.
MethodsSeven strains of monoclonal antibodies against human uMtCK were prepared with prokaryotic expression recombinant proteins from rats, and the best combination of double antibodies was selected by checkerboard titration method. Double antibody sandwich ELISA for the determination of human uMtCK was established by using HRP-labeled McAb 19F11 as a detection antibody and McAb 3C1 as a capture antibody. The methodology performance was evaluated. The serum concentrations of uMtCK in 50 healthy subjects and 85 patients with positive tumor markers [alpha fetal protein (AFP) and carcinoembryonic antigen (CEA)] were determined.
ResultsThe double antibody sandwich ELISA for the determination of human uMtCK was established by selecting the combination of double antibodies. The detection limit was 28.8ng/mL, and the within-run and between-run coefficients of variation (
The established double antibody sandwich ELISA can be used to determine uMtCK in human serum.
现已知存在2种组织和亚细胞定位特异的线粒体肌酸激酶(mitochondril creatine kinase,MtCK)同工酶,即广泛型亚型MtCK(ubiqutous MtCK,uMtCK)和肌膜型亚型MtCK(sarcomeric MtCK,sMtCK)。肌酸激酶同工酶可催化ATP和PCr之间高能磷酸键的可逆转移,并且位于细胞能量代谢的关键细胞器线粒体内,因而是细胞的能量代谢的关键酶之一[
近年来的不同研究显示过量表达的MtCK在某些肿瘤患者的组织和以及细胞系中检出[
1. 样本来源
50份正常血清来源于身体健康、无任何肿瘤标志物升高的健康体检者。85例临床样本来自本实验室随机收集的肿瘤标志物[甲胎蛋白(AFP)或癌胚抗原(CEA)]阳性患者血清,所有样本的血清AFP或CEA浓度均高于参考区间。
2. 试剂和仪器
重组蛋白uMtCK为本实验室克隆并构建的PQE30-uMtCK原核表达质粒经大肠杆菌表达和纯化获得[
1. 小鼠免疫
取500 μg纯化的pQE30-uMtCK抗原加完全佐剂1 mL,4 ℃搅拌过夜,腹腔免疫5只6~8周小鼠,每只约0.3 mL。每隔20 d应用250 μg纯化的pQE30-uMtCK抗原加不完全佐剂加强免疫1次,共3次。
2. 抗体效价测定
免疫后7~10 d内,使用间接两步ELISA测定抗体效价,酶标二抗为羊抗鼠IgG-HRP。
3. 融合与克隆
检测效价后,选取产生抗体效价最高小鼠脾脏B细胞作为融合细胞,4 d后融合。融合方法采用聚乙二醇(PEG)常规融合法,HAT选择培养基培养有限稀释法筛选单克隆化细胞株。
4. 抗体制备与纯化
单克隆的杂交瘤细胞株转至6孔板生长,用无菌生理盐水调整细胞浓度为1×107个/mL,接种小鼠腹腔制备腹水。辛酸硫酸铵沉淀法纯化腹水抗体。
1. 抗体配对实验
分别用包被稀释液包被不同单抗,加入96孔板中,每孔100 μL,37 ℃包被过夜;常规方法洗涤与封闭,加样本(含重组蛋白)100 μL/孔,置37 ℃ 1 h,洗涤3次;分别加入制备的酶标记抗体100 μL/孔,置37 ℃ 1 h,洗涤3次,加TMB显色10 min,终止液终止后450 nm读取吸光度( A)值。按上述步骤确定抗体与酶标抗体是否可以作为配对检测。若抗体表位一致,则酶标抗体不结合,不显色,反之则抗体表位不同,可用作配对检测。
2. 最适包被单抗及标记单抗浓度的确定
用包被液将包被抗体稀释成5、2、1和0.5 μg/mL 4个浓度,包被酶标板。用抗体稀释液将酶标抗体按1∶500、1∶1 000、1∶2 000、1∶4 000和1∶8 000稀释,设定棋盘滴定试验。比较450 nm的 A值,以阳性样本A值1.0左右、阴性样本 A值0.1以下的条件确定最适单抗包被浓度和标记抗体浓度。
1. 标准曲线和检测限
用小牛血清稀释重组蛋白uMtCK制备标准品,浓度范围为25、50、100、200、400、800、1 600 ng/mL、以浓度的常用对数为横坐标, A值为纵坐标,绘制标准曲线。测定10个阴性孔的均值( 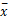
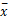
2. 分析精密度确定
在分析范围内取小牛血清稀释100、400 ng/mL重组蛋白溶液以及uMtCK阳性肿瘤患者血清2份,各测定20孔及连续测定20 d,计算批内和批间精密度[用变异系数( CV)表示]。
3.回收试验
以回收试验来证实该检测法的特异性。将uMtCK浓度为300和579 ng/mL的样本为标本,加入uMtCK的标准品50、100、400按体积9∶1混匀,重新测定计数回收率。
为验证uMtCK-ELISA测定人血清的筛查作用,以小牛血清稀释重组蛋白uMtCK为标准品,检测健康体检人群和随机留取的肿瘤标志物阳性样本,对uMtCK-ELISA检出阳性样本进行初步试验。
采用SPSS16.0软件和EXCEL2003软件对结果进行统计分析,所有数据进行正态性检验, P<0.05为差异有统计学意义。
1. 单克隆抗体制备及抗体配对试验
对4只Babl/c小鼠腹腔注射免疫uMtCK重组蛋白4次后,断尾采血取血清。采用间接ELISA方法测定小鼠免疫后抗体效价。取血清效价最高小鼠脾细胞与SP2/0细胞融合,HAT筛选出7株抗体效价较高的细胞株,选择其中效价最好的细胞株3C1、16A6、8G4、19F11。对小鼠腹腔注射后,收集4株杂交瘤细胞株制备的腹水,辛酸硫酸铵沉淀法纯化腹水抗体。采用正交试验法确定包被抗体和酶标抗体的配对。3C1和19F11配对时所得的试验数据最好,因此,以3C1和19F11分别作为包被抗体和酶标抗体。
2. 最适包被单抗及标记单抗浓度的确定
根据棋盘滴定试验结果,最佳包被抗体浓度为2 μg/mL,酶标抗体的稀释度为1∶4 000。
1. 标准曲线和检测限
以小牛血清作为空白,重复测定20次,计算 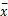
注: Y=-1 ×10 -9 X3 +2 ×10 -6 X2 +0 .001 X-0 .007, R2 =0 .999
2. 精密度试验
4份样本的批内和批间精密度见表1:
| 表1 uMtCK-ELISA精密度试验结果 |
批内 CV为4.5%~7.7%,批间 CV为8.2%~13.5%。
3. 回收试验
取uMtCK浓度分别为134.7和454.3 ng/mL的患者血清,分别与50、200、400 ng/mL的uMtck标准品9∶1混合,测定其回收率。结果显示uMtCK-ELISA的回收率为86.9%~106.1%,平均回收率为97.1%,结果见表2:
| 表2 uMtCK-ELISA回收试验结果 |
采用uMtCK-ELISA检测50份健康体检者血清uMtCK浓度,测定结果均为阴性;85例肿瘤标志物阳性样本中有15例样本检测出uMtCK,浓度范围为52.8~1 442.2 ng/mL,阳性率为17.6%。
MtCK存在于细胞内线粒体内膜和外膜间隙,是细胞能量代谢的关键酶之一。在细胞内,MtCK催化ATP与ADP、肌酸与磷酸肌酸(PCr)间的高能磷酸键转移,实现CK/PCr循环,构建细胞内的能量缓冲和转移系统,对维持细胞内的ATP池的稳定、调节细胞和组织的能量代谢起关键的作用[
目前,已有不同的研究报道MtCK与肿瘤的关系。过量表达的MtCK可见于乳腺癌、肺癌及淋巴瘤等各种恶性肿瘤组织[
目前,对uMtCK的测定方法主要是采用免疫组化方法测定其在组织中的表达以及应用电泳方法测定血清中的活性。电泳方法测定的是MtCK的相对活性,本质仍然是酶活性测定。但是,肌酸激酶对自由基敏感,特别是MtCK尤其敏感,因此,uMtCK可能受血清中的自由基所影响而失活。这可能会影响电泳方法测定的阳性率。因此,我们推测直接测定血清中uMtCK的蛋白也许可以提高阳性率。为此本研究应用本实验室前期研究中基因工程表达的uMtCK重组蛋白免疫小鼠制备单克隆抗体,尝试建立双抗体夹心ELISA方法直接检测血清中的uMtCK蛋白。
免疫小鼠获得7株效价较高的单克隆抗体,选取其中的4株抗体进行配对试验,获得一对可以建立双抗体夹心ELISA的抗体,并以此建立了ELISA方法。该法的检测限为28.8 ng/mL,批内和批间 CV均<15%,平均回收率为97.1%。在随机留取的肿瘤标志物阳性血清中能检出uMtCK阳性样本(17.6%)。由此可见,本研究建立的ELISA方法符合预期的研究目的,为下一阶段研究肿瘤患者血清uMtCK与诊断、预后的相关性奠定了基础。但是,由于本研究建立的检测方法是测定uMtCK蛋白的质量,而不是酶活性,因此,测定结果较难与电泳方法进行比较。同时,也未能检索到测定uMtCK蛋白质量的方法并与之进行比较,这是本研究的欠缺之处。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|