通过活体实验研究血管活性肠肽(VIP)对脑缺血再灌注后胶质纤维酸性蛋白(GFAP)动态变化的影响及星型胶质细胞活化增殖的情况,探讨VIP的神经保护作用。
方法大鼠注射VIP后,用线栓法制作大鼠大脑中动脉再灌注(MCAO)模型。通过神经学评价对MCAO大鼠进行判定和筛选;应用免疫组化技术检测脑缺血区GFAP表达。
结果VIP注射后与对照组相比GFAP表达显著增加(
VIP脑内注射可明显增强GFAP的表达,降低再灌注损伤程度;提示VIP可能具有体外神经保护作用。
To investigate the effects of vasoactive intestinal peptide(VIP) on the dynamic changes of glial fibrillary acidic protein(GFAP) after focal cerebral ischemia-reperfusion in vivo and the proliferation of astrocyte, and discuss the neuroprotective effects of VIP.
MethodsIn rats, VIP was given via injection, and middle cerebral artery occlusion (MCAO) model was set up by suture method. The evaluation and screening of rats with successful occlusion of MCAO were performed by neurological testing. The expression of GFAP was detected by immunohistochemistry.
ResultsCompared with the control groups after VIP injection, GFAP expression significantly increased(
VIP injection enhances the expression of GFAP and reduces the degree of cerebral ischemia-reperfusion injury. This study provides the evidence for the neuroprotective effects of VIP in vivo.
脑组织局部过度的炎症反应是造成再灌注损伤的主要原因之一;而炎症反应核心是细胞黏附分子介导的级联反应导致细胞损伤,并促进继发性神经元损伤[
选用体重240~280 g的健康Wistar雄性大鼠,由北京军事医学科学院实验动物中心提供。安静环境饲养,室温25 ℃左右,自由进食饮水。根据缺血再灌注后时间的不同随机分为缺血再灌注3、6、12、24和48 h 5个时间点,每个时间点又分为VIP组(注射VIP伴脑缺血再灌注)和对照组(非注射VIP伴脑缺血再灌注)。
大鼠经水合氯醛(300 mg/kg)腹腔注射麻醉后,固定于脑立体定位仪,选择右侧脑室[以前囟(Breg-ma点)为0点,向后1.0 mm,旁开1.4 mm,深3.5 mm]为注射区,VIP组注射VIP(0.25 g/L)溶液2 μL,留针10 min,缝合皮肤。对照组用等容量生理盐水做同样处理。
VIP脑内注射后即刻参考Longa等描述的管腔内线栓技术闭塞右侧大脑中动脉(middle cerebral artery occlusion,MCAO)诱导建立暂时性局部脑缺血大鼠模型。大鼠做颈部前正中切口,分离暴露右侧颈部血管,用微动脉夹暂时夹闭颈内动脉,结扎颈总动脉和颈外动脉。将头端加热呈光滑椭圆球形的3-0单股尼龙线经颈外动脉缓慢插入颈内动脉至感到有轻微阻力为止,进线长约18 mm左右。
大鼠MCAO后2 h参照Bederson等方法进行神经功能损伤程度的评定,即0级:行为正常;1级:提尾悬空左侧前肢屈曲,肩内收;2级:抵抗对侧推力下降,伴前肢屈曲;3级:自发性侧向旋转或运动,伴抵抗对侧推力下降和前肢屈曲。评定为3级者被视为成功脑缺血模型并进行进一步的实验。
将固定的脑组织以0.01 mol/L 磷酸盐缓冲液(PBS,pH值7.4)冲洗,将从视交叉至脑桥前缘冠状位切取脑组织,OCT包埋,冰冻切片机连续冠状切片,厚度为20 μm,贴在用多聚赖氨酸处理过的载玻片上用于免疫组化染色。冰冻切片室温干燥1 h,冲洗后滴加酶修复液,并进行非特异性IgG的封闭和阻断;滴加适当稀释比例第一抗体4 ℃孵育过夜。分别滴加各种特异性生物标记抗体,冲洗后避光显色5 min或更长时间,至显色,自来水中终止反应。
所有数据均以 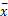
脑缺血再灌注后VIP组及对照组GFAP表达见表1:
| 表1 脑缺血再灌注后不同时间点VIP组和对照组GFAP蛋白的表达 |
VIP组和对照组脑缺血再灌注48 h染色见图1、2:
脑缺血再灌注3 h星型胶质细胞表达增加,至再灌注48 h随时间延长表达持续增高;且每个再灌注时间点VIP组星型胶质细胞数目及积分光密度值均高于对照组( P<0.05)。对照组星型胶质细胞胞体小、突起细、数量少;VIP组在细胞数量增加的同时,体积增大,突起多而粗大,GFAP阳性反应加深。
脑缺血再灌注损伤是一个复杂的病理过程,包括缺血期的原发性损伤和再灌注期的继发性损伤,其始动因素是脑组织缺血缺氧,但再灌注后所造成的损伤不仅于此[
GFAP是星形胶质细胞中间丝蛋白的主要成分之一。当细胞受到刺激时,GFAP的表达将发生变化。而建立一个可重复的、稳定可靠的动物模型是研究脑缺血神经保护作用及其机制所必需的。本研究在对大鼠种系、体重和体温严格控制下,采用神经功能缺陷评分作为模型成功的判定标准,结果显示出现自发旋转或偏向左边运动的大鼠(3级)都同时伴有左侧前肢屈曲、肩内收以及左侧面的推抵抗力减弱。因此,MCAO后2 h进行神经功能缺陷评分,以评分为3级作为模型成功的判定标准是较为可靠的。本研究选取了脑缺血再灌注3、6、12、24和48 h 5个时间点对比观察 VIP组和对照组GFAP的变化。有研究证实[
VIP具有多种生物学功能。自VIP被发现以来,其对神经系统的保护和营养作用不断为人们所认识,在体外被广泛研究。VIP能增强与神经元共同培养的星形胶质细胞摄取谷氨酸的能力,消减谷氨酸介导的神经元的一氧化氮合酶(NOS)变构激活,从而减少NO产生[
总之,在缺血性脑血管疾病尚无有效治疗方法的今天,深入研究VIP与脑缺血再灌注损伤的神经元保护机制的关系,可能会为脑血管疾病的综合治疗提供有益的探索方向。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|



