建立斑点免疫金渗滤法(DIGFA)定量测定血清淀粉样蛋白A(SAA)并评估其分析性能。
方法选用2株商品化抗SAA单克隆抗体,分别结合于硝酸纤维素膜和胶体金,制备免疫金渗滤试剂板条(SAA-DOT)以定量检测SAA。按照EP文件,评估SAA-DOT的分析性能(检测限、精密度、准确性、线性范围等)。
结果SAA-DOT最低检测限为5 mg/L;10和100 mg/L的批内变异系数(
基于DIGFA的SAA-DOT简便、快速,能在5 min内完成检测,各项分析性能指标达到国家食品药品监督管理局(SFDA)对体外诊断试剂的要求,可用于临床患者血清标本的检测。
To establish a dot immuno-gold filtration assay (DIGFA) for the quantitative determination of serum amyloid A (SAA),and evaluate its analysis performance.
MethodsSerum DIGFA-based SAA detection reagent (SAA-DOT) was established using 2 anti-SAA monoclonal antibodies being coated with nitrocellulose filter and labeled by colloidal gold, respectively. According to EP files, the SAA-DOT analysis performances (such as detection limit,precision,accuracy,linear range,et al) were evaluated.
ResultsThe detection limit of SAA-DOT was 5mg/L. The within-run coefficients of variation (
The DIGFA-based SAA-DOT is convenient, and the reaction can be finished within 5 min. Its performance meets the State Food and Drug Administrration (SFDA) requirements for in vitro diagnostic reagents,which is suitable for the clinical applifcation of serum detection.
血清淀粉样蛋白A(serum amyloid A,SAA)是一类多基因编码的多态性蛋白家族,为组织淀粉样蛋白A的前体物质,属急性时相反应蛋白[ 1, 2]。已有研究表明,在细菌、真菌、病毒感染[ 3, 4, 5],动脉粥样硬化[ 5],心血管疾病[ 6, 7, 8],急性移植排斥反应[ 9],肿瘤[ 10]等疾病中均可检测到血清SAA升高,对临床诊断有较好的参考价值。尽管如此,目前国内尚只有一种乳胶增强速率散射比浊法(latex-enhanced rate nephelometry,LERN)试剂经国家食品药品监督管理局(State Food and Drug Adiministration,SFDA)批准用于临床标本SAA的检测,但由于其检测成本相对较高、需配套仪器等原因,SAA检测尚未在临床中广泛应用。斑点免疫金渗滤法(dot immuno-gold filtration assay, DIGFA)因其简便、快速、安全等特点在急诊医学、输血医学、现场诊断及个体自我体检等方面应用非常广泛,已经成为临床医学检验快速诊断(point of care-test,POCT)领域中的主要检测技术[ 11, 12]。我们建立了基于DIGFA的免疫金渗滤试剂板条(SAA-DOT)定量测定血清SAA并评估其分析性能。
1. 试验材料
3株抗人SAA单克隆抗体抗SAA-1、抗SAA-2和抗SAA-3购自HyTest公司(芬兰)。硝酸纤维素膜购自Whatman Ltd公司(英国)。人血清SAA标准品购自英国国家生物制品检定所(National Institute for Biological Standards and Control,NIBSC,NIBSC code: 92/680)[ 13],使用时稀释至相应浓度。
2. 试剂和仪器
N Latex SAA试剂盒为德国西门子公司产品,配套的测定仪器为BN Prospec特定蛋白分析仪;Q-pad金标数码定量阅读仪(上海奥普生物医药有限公司);Avanti J-E离心机(美国Beckman-Coulter公司)。
3. 研究对象
血清取自2012年4至5月瑞金医院体检中心240名表观健康者,其中男120名(年龄21~56岁),女120名(年龄24~58岁)。该240名体检者均无明显的炎症和感染指标,各项体检指标正常。
1. 胶体金溶液、免疫金溶液和反应板的制备
参见文献[11-12]。
2. 抗体的确定
(1)抗体配对:商品化的3株单克隆抗体分别包被胶体金和硝酸纤维素膜,经组合得到6组配对,检测不同SAA浓度的血清标本,根据反应曲线确定最佳的抗体对,分别用于标记胶体金和包被硝酸纤维素膜;(2)抗体工作浓度:最佳抗体对确定后,用7.5、10和15 μg/mL抗体分别标记胶体金,用0.5、1.0和1.5 mg/mL抗体分别包被硝酸纤维素膜,并组成9种组合。将此9种组合测定不同SAA浓度的血清,根据反应曲线确定SAA-DOT中抗体的最佳工作浓度。
3. 标准曲线制备
SAA高值血清稀释至5、10、50、100、150、200和250 mg/L,每个浓度血清重复检测3次,取平均值绘制标准曲线。
4. 操作步骤的确定
将血清用标本稀释液做100倍稀释。在反应板上滴加2滴封闭液,待其完全渗入。取100 μL稀释后的血清加至一洁净Ep管中,再加入100 μL免疫金溶液,充分混匀,并将其全部加至反应板中;待完全渗入后,再滴加2滴清洗液至反应板。液体完全渗入后,将反应板条置于金标数码定量阅读仪上对反应斑点灰度进行检测,计算出血清中SAA的浓度。
1. 敏感性
制备0、2.5、5、10和20 mg/L的5个不同浓度的检测限样本及空白样本(0 mg/L)做10次批内重复测定,另外4个样本做天间重复测定,共做10 d[ 14, 15]。
2. 精密度
分别测定2个浓度的血清样本(10和100 mg/L)。批内精密度由1 h内重复测定20次得到的结果计算。2份样本每天分别测定1次,连续测定20 d,计算得到天间精密度[ 16]。
3. 准确度
回收试验根据文献配制系列回收血清样本,每份样本测定3次,结果取平均值,计算回收率[ 15]。干扰实验根据中华人民共和国卫生部和国家标准化管理委员会颁布的《干扰实验准则》确定各干扰物及其浓度,胆红素为342 μmol/L、甘油三酯为37 mmol/L、血红蛋白为2 g/L 、防腐剂(0.5% NaN3),并配制干扰实验样本和对照样本。将此2种样本各重复测定6次,统计分析两者之间有无差异[ 15]。方法学比对共测定40份血清标本,随机分为5组。每天用SAA-DOT和N Latex SAA试剂盒分别测定8份临床血清样本,每份血清检测2次,连续做5 d,每种方法得到80个数据[ 17]。
4. 线性范围的确定
取浓度为10和2 000 mg/L的2份血清配制成8个浓度的系列血清,用于评价线性范围。每个浓度血清做4次重复测定,对试验数据进行统计处理,得到SAA-DOT的线性范围[ 18]。
5. 参考区间的确定
240名表观健康者根据年龄分为20~29岁、30~39岁、40~49岁和50~59岁4组。每组根据性别再分为男、女2个亚组,每个亚组30例。用SAA-DOT测定各组血清,对结果进行统计分析,观察性别和年龄对SAA浓度的影响,确定240名表观健康者SAA的临界值和参考区间[ 19]。
6. 血清样本稳定性
将SAA浓度为15和175 mg/L的血清分别在4和-20 ℃储存,一定时间后进行检测,并与新鲜血清检测结果进行比较,观察SAA在4和-20 ℃中的稳定性。
采用SPSS13.0统计学软件对数据进行统计学分析。正态分布时2组间比较采用独立样本的 t检验,多组间比较采用方差分析,线性范围采用直线相关分析;非正态分布时2组间比较采用Mann-Whitney U检验,多组间比较采用Kruskal-Wallis H检验,方法间比较采用Spearman相关分析。 P<0.05为差异有统计学意义。
1.基本特性
用于制备SAA-DOT的最适抗体对为抗SAA-1和抗SAA-3。抗SAA-1用于标记胶体金颗粒,最佳工作浓度为10 μg/mL,每次测试免疫金溶液用量为100 μL。抗SAA-3用于包被硝酸纤维素膜,最佳工作浓度为1 mg/mL,包被每块反应板的抗体用量为3 μL。血清标本需先做100倍稀释,每次测定用量100 μL。
2.标准曲线
SAA-DOT标准曲线见图1:
注: Z=空白灰度/斑点灰度×10 000
公式为 Y=-14 .254 X+10 525, r2=0.982。该曲线为SAA浓度在0~250 mg/L时的标准曲线。当样本中SAA浓度>250 mg/L时,需对样本稀释后再进行检测。
1.敏感性
SAA-DOT的检测限试验结果显示,浓度为2.5、5、10和20 mg/L样本天间 CV分别为70.30%、20.77%、12.46%和11.89%。SAA-DOT在测定5 mg/L的SAA样本时天间 CV最接近20%(为20.77%),所以SAA-DOT的检测限为5 mg/L。
2.精密度
SAA-DOT重复测定10 mg/L SAA血清的批内和天间结果分别为10.2±0.92和(10.5±1.19) mg/L,计算得批内和天间变异系数(coefficients of variation, CV)分别为9.07%和11.33%。SAA-DOT重复测定100 mg/L SAA血清的批内和天间结果分别为102.1±10.43和(103.0±11.88) mg/L,计算得批内和天间 CV分别为10.21%和11.53%。
3.准确度
回收实验显示,SAA-DOT的回收率为86.4%;血清中含342 μmol/L胆红素、37 mmol/L甘油三酯、2 g/L血红蛋白及0.5% NaN3对检测结果无明显影响( P>0.05)。方法学比对结果显示,用SAA-DOT和N Latex SAA试剂盒检测SAA的浓度主要分布于0~200 mg/L之间,对2组数据进行Spearman相关分析,相关系数( r)=0.995( P<0.05)。见图2:
注:(a)SAA-DOT和N Latex SAA试剂盒测定结果;(b)SAA-DOT和N Latex SAA试剂盒测定结果的线性相关分析
4.线性范围
SAA-DOT的线性范围为5~230 mg/L,其回归方程的截距和斜率分别为 a=-0.766 2, b=1.009 1,差异无统计学意义( P>0.05),见图3:
5.参考区间
240名表观健康者SAA测定结果见表1:
| 表1 240名表观健康者血清SAA浓度(mg/L) |
SAA浓度在各年龄组中呈偏态分布,故以中位数和95%可信区间进行统计分析。各年龄组内SAA浓度在男、女性之间无明显差异( P>0.05);随着年龄增长SAA浓度逐渐升高,50~59岁组SAA浓度中位数和临界值均高于其他3组,但只与20~29岁组、 30~39岁组差异有统计学意义( P<0.05),而与40~49岁组相比,差异无统计学意义( P<0.05)。如果不考虑性别和年龄因素,所有240名表观健康者SAA浓度中位数为5.7 mg/L,95%可信区间为0~9.6 mg/L。将240名表观健康者根据年龄分为<50岁组和≥50岁组,2组SAA浓度中位数分别为5.3和6.2 mg/L,95%可信区间分别为0~8.2和0~10.4 mg/L。≥50岁组SAA浓度中位数和临界值明显高于<50岁组( P<0.05)。
6.SAA的稳定性
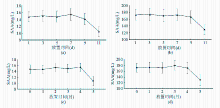
在4 ℃放置9 d内检测结果稳定,第9天检测结果与第1天检测结果间差异无统计学意义( P>0.05),但放置第11天时的检测结果和第1天比较差异有统计学意义( P<0.01),见图4(a)、(b)。血清于-20 ℃条件下4个月内检测结果稳定 ( P>0.05),但放置第5个月时的检测结果与第1天的检测结果相比明显降低( P<0.01),见图4(c)、(d):
注:(a)15 mg/L,4℃; (b)175 mg/L,4 ℃; (c)15 mg/L,-20 ℃; (d)175 mg/L,-20 ℃
目前,国内用于临床患者血清SAA测定的商品化试剂较少,因此血清SAA测定在临床疾病中的应用受到一定程度的制约。我们研制的SAA-DOT基于DIGFA,应用双抗体夹心法原理检测SAA。由于每株抗体所针对的SAA抗原决定簇不同,因此选择合适的抗体至关重要。经配对比较,最终选用抗SAA-1标记胶体金颗粒、抗SAA-3包被硝酸纤维素膜,其敏感性和线性结果较其他抗体配对组合更好。机体受炎症刺激后血清中SAA浓度可达基础浓度的1 000倍,用双抗体夹心法检测SAA浓度较高的血清样本时有可能产生Hook效应,此时需对血清预先稀释。虽然稀释倍数越高SAA-DOT的检测范围越大,但较高的稀释倍数也会降低检测敏感性。实验证明,血清经稀释50倍后即可避免由于SAA浓度较高而产生的Hook效应,经100倍稀释后既能满足常见临床样本的检测,也仍具有相对较好的检测敏感性。所以,我们选择将血清预稀释100倍后检测。对于SAA浓度较高的血清样本(>230 mg/L)需扩大稀释倍数后再测定,测定结果按相应稀释倍数计算获得。
我们根据EP文件对SAA-DOT的检测限、精密度、准确度、线性范围、参考区间等方面的性能进行了验证。20%的天间 CV是试验诊断所允许的最大不精密度,所以将天间 CV为20%或最接近20%的检测限样本浓度作为检测系统可定量报告分析物的检测限最为保险,可确保测定结果是准确的[ 14, 15]。SAA-DOT重复测定2.5 mg/L SAA样本的天间 CV为70.30%,重复变异较大,不能将2.5 mg/L作为SAA-DOT的检测限。SAA-DOT重复测定10和20 mg/L SAA样本的天间 CV<20%。只有在重复测定SAA浓度为5 mg/L的样本时天间 CV最接近20%(20.77%),所以将SAA-DOT的检测限设定为5 mg/L较为合适。
POCT体外诊断试剂的 CV须<15%方可用于临床患者样本的检测[ 15, 16],SAA-DOT的批内、天间 CV均<15%,能满足临床患者样本测定的要求。由于高血脂、高胆红素和高血红蛋白对SAA的检测无干扰,因此即使患者血清中这些物质含量较高,用SAA-DOT检测仍能客观地反映患者样本中SAA的含量。
比对试验显示,SAA-DOT与N Latex SAA试剂盒相关性较好,虽然少数高值样本用商品化试剂测定的结果较SAA-DOT稍高,但是两者间差异无统计学意义。这种差异可能是由于两者的方法学不同、检测所用抗体不同(SAA-DOT为单克隆抗体,N Latex SAA为多克隆抗体)等原因所致。
线性范围是评价检测方法在此范围内检测不同患者样本的结果是否能反映患者样本中的真实水平[ 15, 18]。本研究SAA-DOT在5~230 mg/L范围内的检测结果可真实反映患者血清SAA浓度。
参考区间的确立对于检验项目运用于临床至关重要。本研究结果显示男、女之间SAA浓度差异无统计学意义;但随着年龄的增长,SAA浓度逐渐升高[ 20]。提示在实际应用中应确立各年龄段的参考区间,充分考虑年龄因素对SAA浓度的影响。
血清样本的保存是医学检验工作中的重要环节。根据试验结果并考虑到临床操作的可行性,我们建议尽可能取新鲜血清样本进行测定,并且在4 ℃保存时间不应超过7 d。如果样本需要长期保存,则应在样本采集后24 h内即于-20 ℃下储存(可长达4个月),在此期间应避免反复冻融。
我们制备的基于DIGFA的试剂板条SAA-DOT的分析性能达到了相关检测标准,检测方法简便、快速,可满足临床样本检测的要求。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|