探讨聚乙二醇(PEG)沉淀法检测巨泌乳素(MPRL)方法的可行性。
方法将26例高泌乳素血症(HPRL)患者按临床表现和影像学资料分为真性HPRL组(简称真泌组)11例及MPRL血症组(简称巨泌组)15例。采用凝胶色谱层析(GFC)法分离泌乳素(PRL)各组分,检测各组分PRL浓度,同时将所有标本进行PEG沉淀,检测处理后单体PRL浓度,并与GFC法单体PRL检测结果进行相关性分析。
结果巨泌组与真泌组的PRL层析谱不同,真泌组以单体PRL为主,而巨泌组以巨PRL为主。真泌组与巨泌组血清处理前总PRL浓度差异无统计学意义(
PEG沉淀法检测MPRL结果与GFC法有良好的相关性,且经济、简便、易行,可作为临床常规筛查方法。
To investigate the feasibility of polyethylene glycol(PEG)precipitation treatment in the detection of macroprolactine(MPRL).
MethodsA total of 26 hyperprolactinemia (HPRL) patients were classified into 2 groups: genuine HPRL group (11 cases) and macroprolactinemia group (15 cases) according to the clinical and imaging data. By gel filtration chromatography (GFC), the components of prolactin (PRL) were separated, and their levels were determined. After PEG precipitation treatment, the concentration of monomer PRL was determined, the results were compared with those by GFC, and the correlation was analyzed.
ResultsThe chromatogram of macroprolactinemia group was different from that of genuine HPRL group. The genuine HPRL group was consisted of monomer PRL, but the macroprolactinemia group was consisted of big PRL. The 2 groups' PRL before the treatment had no statistical significance (
PEG precipitation treatment for the detection of MRPL has good correlation with GFC, and it is economical and convenient. It is recommended as the routine screening method.
泌乳素(prolactin,PRL)是垂体前叶分泌的一种多肽类激素。PRL的正确检测关系到临床正确诊断、合理治疗和预后的判断。文献报道[ 1, 2]巨泌乳素(macroprolactin,MPRL)的存在是导致高PRL的重要原因之一。MPRL能被某些免疫检测仪误认为PRL报告给临床,给高泌乳素血症(hyperprolactinemia,HPRL)的诊断带来很大干扰。如何排除干扰,提高PRL检测的准确性已成为临床和实验室关注的重点。
目前,凝胶色谱层析(gel filtration chromatograpy,GFC)法被公认为检测MPRL的金标准[ 3],但因检测技术较复杂,检测时间长且费用昂贵而不适合临床常规筛查。相比较而言,聚乙二醇(polyethylene glycol, PEG)沉淀法经济、简便、易行。我们对PEG沉淀法与GFC法进行比较,初步探讨PEG沉淀法检测MPRL的可行性。
选自2009年1月至2010年1月就诊于天津医科大学总医院妇产科及内分泌科的HPRL患者26例,均为女性,年龄18~46岁。所有标本经Bayer ACS180化学发光免疫分析仪测定血清PRL后,留取血清-70 ℃保存待检,同时搜集该病例的临床诊断及影像学资料,根据临床诊断、影像学资料及实验室检测分为真性HPRL组(简称真泌组)11例及MPRL血症组(简称巨泌组)15例。
1. 凝胶色谱柱
规格1.6 cm×80 cm 凝胶色谱柱购自天津嘉悦玻璃制品有限公司。
2.填充介质
Sephadex G100 购自美国法玛西亚生物有限公司。
3.组分定标
兰葡聚糖(相对分子质量2.5 ×103),乙醇脱氢酶(相对分子质量150×103),牛血清白蛋白(相对分子质量66×103),碳酸酐酶(相对分子质量29×103),以上标准品均购自美国Sigma-aldrich 公司。根据定标体积收集目标组分。
4.洗脱缓冲溶液配制
10 mmol/L Tris 缓冲液(pH值7.4),含10 mmol/L Tris、140 mmol/L NaCl、1.25 mmol/L CaCl2、0.5 mmol/L MgCl2及0.02%NaN3。使用前用0.4 μm滤膜抽滤,4 ℃保存待用。
5.仪器
BS-100A 型自动部分收集器及自动恒流泵均购自上海沪西分析仪器有限公司。UV-2501型紫外分光光度检测仪购自日本岛津公司。
6.标本预处理
血清自-70 ℃取出融化后平衡至室温,混匀后2 000× g离心10 min,取血清中段,用0.2 μm滤膜过滤,吸取血清待用。
7.GFC法上机分离参数
流速0.5 mL/min,上样量1.0 mL。洗脱相为10 mmol/L Tris 缓冲液(pH值7.4)。
8.收集组分
每收集1.5 mL为一管,每份标本收集100管,经Bayer ACS180化学发光免疫分析仪检测PRL浓度。将检测结果录入EXCEL 表格并绘制PRL层析图。
1.PRL检测
Bayer ACS180化学发光免疫分析仪及其配套试剂均购自美国拜耳公司,高、中、低值质控品均购自美国伯乐公司。PRL检测灵敏度为0.3 ng/mL,批内变异系数( CV)为2.5%~3.8%,批间 CV为3.6%~4.5%。
2. MPRL筛查
25%PEG(相对分子质量为6 000)购自北京鼎国生物技术有限公司,溶液4 ℃保存用作MPRL的沉淀剂。AllegraTM Centrifuge超速冷冻离心机购自美国贝克曼公司。
3. MPRL筛查方法
每份血清取250 μL,加等量的25%PEG溶液,充分混匀后室温放置30 min,4 ℃ 2 000× g离心30 min,取上清液分别检测PRL值。PRL测定回收率=[(PEG沉淀后PRL值×2)/PEG沉淀前PRL值]×100%,回收率≤40%提示该标本含有MPRL[ 4, 5, 6]。
采用SPSS11.5软件进行统计处理。因数据呈偏态分布,故采用中位数( P2.5~ P97.5)表示。多组数据比较采用Wilcoxon符号秩检验,组间比较采用非参数Kruskal-Wallis H检验,线性回归分析采用Spearman相关系数。 P<0.05为差异有统计学意义。
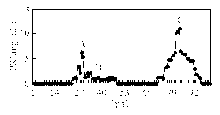
混合标准品分离结果见图1:
注:A为乙醇脱氢酶;B为牛血清白蛋白;C为碳酸酐酶
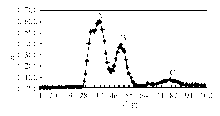
根据目标PRL相对分子质量大小,依据定标体积收集相应组分。MPRL血症色谱分离结果见图2:
注:A为MPRL;B为大PRL;C为单体PRL
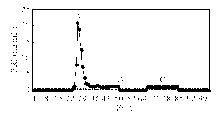
,HPRL色谱分离结果见图3:
注:A为MPRL;B为大PRL;C为单体PRL
真泌组与巨泌组血清处理前总PRL浓度差异无统计学意义( P=0.113),而处理后真泌组明显高于巨泌组( P<0.05),结果见表1:
| 表1 真泌组和巨泌组PEG处理前、后PRL浓度比较(ng/mL) |
采用GFC法与PEG沉淀法检测真泌组和巨泌组单体PRL浓度差异无统计学意义( P<0.05),结果见表2:
| 表2 GFC法与PEG沉淀法检测真泌组与巨泌组单体PRL浓度(ng/mL) |
GFC法与PEG沉淀法检测真泌组与巨泌组单体PRL回收率差异无统计学意义( P>0.05),结果见表3:
| 表3 GFC法与PEG沉淀法检测真泌组与巨泌组单体PRL回收率(%) |
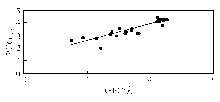
PEG沉淀法与GFC法的相关性良好[相关系数( r)=0.844, P=0.000],见图4:
垂体前叶嗜酸性细胞合成的PRL含有199个氨基酸,其中包括6个半胱氨酸。经GFC法确认,主要存在3种不同相对分子质量的PRL,即有活性的23×103的单体PRL、无或低生物活性而有免疫反应性的(45~60)×103的大PRL及>100×103的MPRL。正常人血清中单体PRL约占85%~95%,MPRL仅约占1%[ 7]。
GFC法作为MPRL血症经典的确证试验,最大的优点是能很好的区分MPRL、大PRL及单体PRL,直接证明血清中MPRL的存在,并能通过色谱洗脱曲线峰下面积计算PRL各种分子形式的比例和含量。
本研究中真性HPRL患者与MPRL患者血清总PRL浓度在PEG处理前差异无统计学意义( P=0.113),表明MPRL血症与真性HPRL在生化指标上很难区分,而PEG处理后真泌组明显高于巨泌组( P<0.05),提示MPRL具有免疫反应性,对某些检测系统免疫检测造成干扰[ 8]。本研究利用GFC法证实的MPRL血症与真性HPRL患者单体PRL比例不同,真性HPRL中单体PRL占46.12%~81.73%,MPRL血症中单体PRL仅占7.43%~35.95%,二者比较有明显差异( P=0.000)。
本研究表明PEG沉淀法与GFC法具有良好的相关性( r=0.844, P=0.000),与Lucille等[ 3]报道的研究结果相一致( r=0.80),且本研究结果也表明PEG沉淀法具有良好的稳定性。
Quinn等[ 9]报道在PRL增高患者中有25%存在MPRL,真性HPRL和MPRL血症不能仅仅根据临床表现区分。因此,正确诊断HPRL,避免不必要的检查和不恰当的治疗、随访,对PRL增高的患者进行筛查是有必要的。尽管GFC法是检测MPRL的金标准[ 10],但由于技术复杂、检测时间长、费用昂贵,限制了其在实验室中的常规使用。本研究对PEG沉淀法与GFC法进行方法学比较,初步结果表明PEG法与GFC法具有良好的相关性,且简便、易行。可考虑作为实验室MPRL血症的常规筛查方法。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|