了解临床分离的产超广谱β-内酰胺酶(ESBLs)的革兰阴性肠杆菌科细菌中16S rRNA甲基化酶基因的分布情况。
方法对临床分离的70株革兰阴性肠杆菌科细菌用VITEK-32型全自动微生物分析系统进行细菌鉴定,用纸片扩散法检测ESBLs,并用聚合酶链反应(PCR)检测
70株产ESBLs革兰阴性肠杆菌中,9株16S rRNA甲基化酶基因阳性,其中5株检出
不同地区医院16S rRNA甲基化酶基因的分布情况各不相同。
To investigate the distribution of 16S rRNA methylase genes in extended-spectrum beta-lactamases (ESBLs)-producing Gram-negative
A total of 70 isolates of Gram-negative
From the 70 isolates of ESBLs-producing Gram-negative
The distribution of 16S rRNA methylase genes is various in the hospitals from different regions.
产超广谱β-内酰胺酶(extended-spectrum beta-lactamases,ESBLs)的革兰阴性肠杆菌科细菌是医院感染的重要病原菌,表现为多重耐药,给临床抗感染治疗带来了极大的困扰。近年来研究发现,一类由质粒介导的16S rRNA甲基化酶可使细菌的30S核糖体16S rRNA不与氨基糖苷类药物结合,从而导致细菌对氨基糖苷类药物出现高水平耐药[ 1, 2, 3]。有研究显示16S rRNA甲基化酶基因常与ESBLs基因位于同一质粒上,可在不同菌种间水平传播或同种间克隆传播,从而造成多重耐药性的传播[ 4, 5]。本研究对从临床标本中分离的70株产ESBLs革兰阴性肠杆菌科细菌进行了16S rRNA甲基化酶基因筛查,以了解其流行情况,为进一步研究该耐药基因的分布情况以及提高临床抗感染治疗效果提供依据。
2009年10月至2011年10月从昆明市延安医院临床标本中分离的ESBLs阳性的非重复性革兰阴性肠杆菌科细菌70株,包括大肠埃希菌、肺炎克雷伯菌、产酸克雷伯菌、奇异变形杆菌。药物敏感性质控菌株为大肠埃希菌(ATCC 25922),ESBLs表型确认试验质控菌株为肺炎克雷伯菌(ATCC 700603)。
亚胺培南、美罗培南、环丙沙星药物敏感性纸片为英国Oxoid公司产品,其余药物敏感性纸片为北京天坛药物生物技术开发公司产品。药物敏感性试验用水解酪蛋白胨培养基为英国Oxoid公司产品。
用法国生物梅里埃公司VITEK-32型全自动微生物分析系统进行细菌鉴定。
采用美国临床实验室标准化委员会(National Committee for Clinical Laboratory Standands, NCCLS)推荐的双纸片扩散法。使用头孢噻肟(CTX)和头孢噻肟-克拉维酸(CTX-CA)、头孢他啶(CAZ)和头孢他啶-克拉维酸(CAZ-CA)2对纸片进行ESBLs表型确认试验,严格按照NCCLS推荐的操作指南和结果判断标准进行,以肺炎克雷伯菌(ATCC 700603)为ESBLs阳性对照株。
用细菌基因组提取试剂盒(天根生物技术有限公司生产)提取细菌DNA作为模板,按试剂盒说明书操作。
采用聚合酶链反应(polymerase chain reaction, PCR)检测6种16S rRNA甲基化酶基因,仪器为Biometra Personal Cycler PCR仪,TaKaRa Ex Taq购自TaKaRa公司,PCR扩增引物由Invitrogen公司合成,靶基因引物序列见表1[ 6]:
| 表1 PCR 引物序列 |
6种16S rRNA甲基化酶基因PCR扩增体系均为:模板1 μL,P1引物0.8 μL,P2引物0.8 μL,dNTP 1.6 μL,10×Ex Taq Buffer 2 μL,Ex Taq 0.2 μL,无菌去离子水补足至20 μL。热循环参数均为:95 ℃预变性3 min,然后95 ℃ 60 s→55 ℃ 60 s→72 ℃ 60 s,循环30次,72 ℃延伸10 min。产物经1.5%琼脂糖凝胶电泳,溴化乙锭染色,Bio-Rad Laboratories 6000凝胶成像系统观察结果,并摄像保存。PCR产物与购自上海美季生物技术有限公司的DNA相对分子质量标准(DL2000)对比,出现相应长度目的条带即为阳性, armA基因阳性对照DNA由浙江大学医学院俞云松教授惠赠。
β-内酰胺酶基因扩增的阳性产物经纯化后,用ABI 377全自动DNA序列分析仪进行序列测定,所测序列用NCBI(http ://www. ncbi. nlm. nih. gov)的BLAST进行序列比对和同源性分析。
70株革兰阴性肠杆菌科细菌分别为大肠埃希菌、肺炎克雷伯菌、产酸克雷伯菌、奇异变形杆菌。
70株革兰阴性肠杆菌科细菌经ESBLs表型确认试验鉴定均为ESBLs阳性。
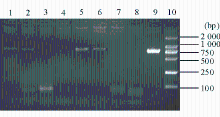
70株产ESBLs革兰阴性肠杆菌科细菌进行6种基因扩增,有9株16S rRNA甲基化酶基因阳性,其中5株 armA基因扩增阳性、4株 rmtB基因扩增阳性、2株 armA和 rmtB基因同时扩增阳性;16S rRNA甲基化酶基因的携带率约为10%。 rmtA、 rmtC、 rmtD、 npmA 4种基因扩增均为阴性。PCR产物电泳结果见图1:
注:1、2为 arm A扩增阳性产物;3为 rmtA扩增阴性产物;4为 rmtC扩增阴性产物;5、6为 rmtB扩增阳性产物;7为 rmtD扩增阴性产物;8为 npmA扩增阴性产物;9为 armA阳性对照扩增产物;10为DNA相对分子质量标准
有文献报道,在医院感染中产ESBLs的耐药菌株有较高的检出率[ 7]。临床治疗产ESBLs菌株感染一般选用碳青霉烯类抗菌药物和含有酶抑制剂的复合制剂,或根据药物敏感性试验结果选用氨基糖苷类和喹诺酮类抗菌药物。产ESBLs的菌株常常表现为多重耐药。目前普遍认为细菌对氨基糖苷类药物耐药的主要机制是细菌产生了可以水解氨基糖苷类药物的酶,但这些水解酶不能水解所有的氨基糖苷类药物,如阿贝卡星。近年研究发现,一类由质粒介导的16S rRNA甲基化酶能使药物作用靶位16S rRNA G1405上的N-7位鸟苷变为7-甲基鸟苷或将A1408上的腺嘌呤N-1位甲基化,致使细菌的30S核糖体16S rRNA与氨基糖苷类药物的亲和力下降,从而出现对氨基糖苷类药物的高水平耐药,其最低抑菌浓度值往往高达512~1 024 μg/mL[ 1, 2, 3, 4, 8],因此产16S rRNA甲基化酶可使细菌对氨基糖苷类抗菌药物耐药。有研究发现16S rRNA甲基化酶基因与β-内酰胺酶基因存在连锁关系,常与碳青霉烯酶或ESBLs编码基因连锁传播[ 9],通过质粒介导,以转化、转导、结合或传递等方式在同种或不同种属菌株间转移和传播,造成院内感染流行,对氨基糖苷类和β-内酰胺类抗菌药物的临床应用产生严重的影响。
到目前为止,在革兰阴性杆菌中已发现 armA、 rmtA、 rmtB、 rmtC、 rmtD和 npmA 6种16S rRNA甲基化酶基因。在一些欧美国家已有质粒介导16S rRNA甲基化酶临床分离株引起感染的报道[ 1, 3, 10, 11, 12],但不同地区甲基化酶流行的基因类型有差异,北美洲主要以 armA和 rmtB为主,欧洲以 armA为主,拉丁美洲以 rmtD为主[ 12]。2004年中国台湾地区分离的肺炎克雷伯菌 armA和 rmtB的阳性率分别为0.4%和0.04%[ 3]。国内不同地区医院16S rRNA甲基化酶基因检出率也各有不同,沈晓强等[ 9]报道在6省市临床分离的447株产ESBLs的菌株中筛选到1株产 armA型16S rRNA甲基化酶的产酸克雷伯菌,吴蓉等[ 6]报道从上海普陀区中心医院临床分离的53株对庆大霉素和/或阿米卡星耐药的革兰阴性杆菌中筛选出10株产16S rRNA甲基化酶的菌株。
本研究结果显示70株产ESBLs革兰阴性肠杆菌科细菌中,9株16S rRNA甲基化酶基因阳性,其中5株检出 armA基因、4株检出 rmtB基因、2株同时检出 armA和 rmtB基因, rmtA、 rmtC、 rmtD、 npmA 4种基因均未检出,与国内其他地区的检测结果存在一定差异[ 6, 9],导致菌株耐药基因携带率不同的原因可能与菌株来源(地理位置)和各地区医院抗菌药物的使用习惯不同有关。检测结果提示昆明市延安医院产ESBLs革兰阴性肠杆菌中16S rRNA甲基化酶基因的携带率约为10%,今后仍应重视对该耐药基因的早期筛查和监控,本课题组也将扩大样本种类及样本量继续追踪调查本地区耐药基因的流行情况。同时值得注意的是,有2株细菌同时检出 armA和 rmtB基因,课题组将对此2株细菌进行深入研究,分析其耐药基因的传递转移,为控制医院感染的流行提供科学依据。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|