作者简介:高 波,男,1981年生,硕士,主管技师,主要从事分子生物学检验工作。
通讯作者:张吉才,联系电话:0719-8801063。
检测原发性肝癌组织及细胞系Hep3B、 HepG2中甲基化转移酶(DNMT)mRNA的表达,分析乙型肝炎病毒(HBV)感染与DNMT mRNA表达之间的关系。
方法应用实时荧光定量聚合酶链反应(PCR)检测44例原发性肝癌组织及2种肝癌细胞系中
32例血清HBV标志物阳性患者肝癌组织中
HBV相关原发性肝癌组织和肝癌细胞系中存在DNMT mRNA表达增高; HBV感染可能刺激DNMT mRNA的表达,进而促进抑癌基因的甲基化。
To investigate the expression of DNA methyltransferase(DNMT) mRNA in Hep3B, HepG2 and hepatocellular cancer tissues,and to analyze the relationship between hepatitis B virus(HBV) infection and DNMT mRNA expression.
MethodsFluorescence quantitative polymerase chain reaction (PCR) was used to determine the mRNA expressions of
In HBV-associated cancerous tissues,the mRNA expression levels of
Overexpression of DNMT mRNA is detected in HBV-associated Hep3B, HepG2 and hepatocellular cancer tissues. The HBV infection can stimulate the expression of DNMT mRNA,and involve the methylation of tumor-suppressor genes.
我们既往的研究发现原发性肝癌组织中 p16基因发生甲基化的频率非常高,并且通过分组发现乙型肝炎病毒(hepatitis B virus, HBV)感染相关肝癌的 p16基因甲基化的频率要高于非HBV相关肝癌,提示HBV的持续感染对 p16基因的异常甲基化有一定作用,但其作用机制尚不明确[ 1, 2, 3]。基因的异常甲基化可能与多种因素有关,包括甲基化转移酶(DNA methyltransferase,DNMT) 水平、致癌物接触、基因修复缺陷等,其中DNMT是调节甲基化的主要因素。为了解HBV感染与DNMT表达之间的关系,本研究采用荧光定量聚合酶链反应(polymerase chain reaction, PCR)检测44例原发性肝癌组织和HBV相关肝癌细胞系Hep3B、非HBV相关肝癌细胞系HepG2中4种DNMT mRNA(DNMT1、DNMT2、DNMT3A、DNMT3B)的表达情况,初步探讨DNMT mRNA表达改变与HBV感染及肝癌等的关系。
收集太和医院2010年12月1日至2012年2月1日的肝癌患者术后新鲜癌组织标本44例,患者男35例,女9例。所有组织标本均经病理学确诊,临床资料完整。组织标本收集后液氮中保存备用。根据患者血清中HBV标志物的存在与否,将癌组织分为2组。HBV相关性肝癌组:共32例,患者血液标本中至少检测出一种HBV感染的标志物,HBsAg、HBeAg、抗HBe、抗HBc或HBV DNA;非HBV相关性肝癌组:血液标本中未检测出任何一种HBV感染标志物,共12例。
肝癌细胞系Hep3B和HepG2购于中国科学院典型培养物保藏委员会细胞库,来自于美国标准生物品收藏中心;细胞培养基DMEM、小牛血清均购于GIBCO公司;Trizol Reagent(Invitrogen公司);逆转录试剂盒(Promege公司);PCR试剂(上海生工公司);PCR仪PE7500(ABI公司);SYBR GreenⅠ染料(Gene公司);G-BOX紫外凝胶成像系统(Gene公司);ND-2000微量核酸定量仪(美国NanoDrop公司);150 bp DNA mark(上海生工公司);DNA mark(北京天根公司);TG-16WS台式高速冷冻离心机(日立公司)。
1. PCR引物设计与合成
DNMT1:5'-CGACTACATCAAAGGCAGCAACCTG-3',5'-TGGAGTGGACTTGTGGGTGTTCTC-3',扩增产物166 bp;DNMT2:5'-AAGCTGTAAGCCAGCCCATATAC-3',5'-TCAGCAGTGAACAGAACCTACATG-3',扩增产物148 bp;DNMT3A:5'-CGAGTCCAACCCTGTGATGATTG-3',5'-GCTGGTCTTTGCCCTGCTTTATG-3',扩增产物221 bp;DNMT3B:5'-TTGGAATAGGGGACCTCGTGTG-3',5'-AGAGACCTCGGAGAACTTGCCATC-3',扩增产物152 bp;GAPDH:5'-GAAGGTGAAGTCGGAGTC-3',5'-GAAGATGGTGATGGGATTTC-3',扩增产物226 bp。所有引物合成由北京赛百盛公司完成。
2. 细胞培养
人肝癌细胞株HepG2(HBsAg阴性)和Hep3B(HBV阳性)待复苏后培养于含100 mL/L小牛血清、100 kU/L青霉素、100 mg/L链霉素的 DMEM培养液,培养在6孔培养板中,置于5%CO2的37 ℃的细胞培养箱,每3~4天消化传代1次。培养结束时,先把培养液抽干,加入3 mL 0.05%胰蛋白酶-乙二胺四乙酸消化细胞,置于37 ℃ 2 min后收集细胞,再以磷酸盐缓冲液洗涤细胞备用。
3. 癌组织及细胞总RNA提取
参照Trizol说明书提取细胞中总RNA。
4. 逆转录
参照试剂盒说明书将总RNA逆转录为cDNA。
5. PCR扩增
按试剂盒要求操作。反应条件:95 ℃ 预变性3 min;95 ℃ 30 s,55 ℃ 1 min,72 ℃ 1 min,共40个循环;最后一循环于72 ℃ 5 min。
6. 结果判断
基因相对定量方法:利用检测得到的Ct 值和计算得到的扩增效率,以参比基因( GAPDH)为内参,计算mRNA的相对表达量。 R=Test mRNA/参比mRNA=(1 + E参比)Ct(参比) / (1 + Etest)Ct(test)
应用SPSS13.0统计软件进行结果分析,计量资料经检验符合正态分布的,采用 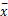
2种肝癌细胞系重复5次培养,收集细胞后提取总RNA,待浓度和纯度符合要求后进行逆转录及PCR扩增,最后进行各个基因表达检测,基因表达的结果用 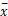
Hep3B细胞系中DNMT1、DNMT3A、DNMT3B mRNA表达高于HepG2细胞系( P<0.01)。见表1:
| 表1 2株肝癌细胞系中DNMT mRNA的表达(R) |
HBV感染相关癌组织中DNMT1、DNMT3A和DNMT3B mRNA表达水平明显高于非HBV感染相关癌组织( P<0.05)。见表2:
| 表2 肝癌组织中DNMT mRNA的表达分析 |
至今发现的DNMT至少有4种亚型,分别为:DNMT1、DNMT2、DNMT3A和DNMT3B,主要功能是维持甲基化和全程甲基化。甲基化是在DNMT的催化作用下加到C上形成mC[ 4],从理论上讲应与DNMT的结构和/或活性异常有关。DNMT1的主要功能是保证新合成的DNA具有高度的保真性,并且维持甲基化转移酶的功能[ 5]。DNMT2的作用目前尚不明确,可能与着丝粒区域的甲基化控制有关。DNMT3A和DNMT3B在原始胚胎形成中起重要的作用,主要功能是催化DNA甲基化的新生位点。正常细胞DNMT1的过度表达可导致CpG岛超甲基化,促进细胞转化。有研究表明,部分肿瘤细胞的DNMT水平表达明显高于正常细胞,并且与某些抑癌基因的超甲基化状态相关[ 6]。在细胞周期中不同的DNMT mRNA可能受不同的调节机制调控,异常的DNMT表达可引起甲基化改变,且DNMT功能改变可引起异常甲基化或正常甲基化模式的丢失,导致DNA甲基化模式的转换。与DNMT相关的因素可能有:(1)与DNMT1忠诚性有关;(2)与DNMT3A和DNMT3B的错误靶向有关;(3)与错误的甲基化修复机制有关;(4)与DNMT的活性异常有关;(5)与染色质构型重塑(chromatin remodeling)有关。
HBV感染与肝癌之间的关系十分密切,流行病学调查发现肝癌患者HBsAg阳性率可达90%[ 7]。国内外的研究也表明持续的HBV感染所导致的部分抑癌基因甲基化是肝癌发生、发展过程中的早期事件[ 3, 8, 9]。虽然持续的HBV感染可以导致部分抑癌基因的甲基化发生,但是这其中的机制尚不明确。本研究采用定量PCR检测HBV相关性与非HBV相关性肝癌细胞系中4种DNMT mRNA表达水平的变化,探讨HBV感染是否对一种或多种DNMT mRNA的表达水平产生影响。
在本结果中发现HBV感染肝癌组织和非HBV感染肝癌组织间DNMT mRNA表达水平不同。HBV感染相关肝癌组织中DNMT1、DNMT3A和DNMT3B mRNA水平明显高于非HBV感染相关癌组织,还发现可分泌HBsAg的Hep3B细胞这3种DNMT mRNA表达也高于HBsAg阴性的HepG2细胞。上述试验结果表明HBV的病毒组分可以剌激受染细胞DNMT mRNA的表达,进而促进抑癌基因的甲基化。甲基化酶的表达异常改变可能与基因异常甲基化和肿瘤形成有关,在多种肿瘤中均可见DNMT mRNA的过度表达。国内许军等[ 10]在研究人肝癌细胞株、人正常肝细胞株及癌旁细胞株中DNMT3B的表达发现,肝癌细胞株中DNMT3B mRNA的表达要明显高于正常和癌旁细胞株,提示DNMT3B的高表达可能与肝癌的发生相关。
病毒感染与DNMT之间的这种关系并不只存在于肝癌细胞中。有研究表明除HBV外的其他病毒及其组分也可通过激活DNMT的活性从而进一步使抑癌基因的表达下降。Tsai等[ 11]在培养的鼻咽癌细胞系中发现,经过EB病毒感染的癌基因产物(LMP-1)能够诱导DNMT1、DNMT3A、DNMT3B的表达,进而使 E-cadherin基因发生甲基化。EB病毒是胃癌发生的一个潜在危险因子,研究发现,在胃癌发生过程中,DNMT1的高表达与h-MLH、thrombospondin-1、E-cadherin等基因启动子甲基化和CpG岛甲基化表型相关,并且这些基因的甲基化均与EB病毒感染有关[ 12]。HB病毒感染、DNMT活性改变、基因甲基化都是肝癌形成的早期事件,那么从某种程度上讲,三者具有潜在的关联,HBV感染作为肝癌形成的一个外部生物因子,可能通过刺激 DNMT基因的表达,进而促进抑癌基因甲基化而参与肝癌形成,这也为了解肝癌的发生机制提供了一个新的思路。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|


