探讨骨髓增生异常综合征(MDS)患者外周血及骨髓
运用逆转录聚合酶链反应(PCR)检测75例MDS患者外周血和骨髓及30名正常对照者外周血有核细胞
MDS患者外周血及骨髓
MDS患者外周血和骨髓高表达
To investigate the expressions of
The reverse transcription polymerase chain reaction (PCR) was used to detect the expressions of
The expression of
骨髓增生异常综合征(myelodysplastic syndrome, MDS)是一组获得性造血干细胞克隆性疾病,以血细胞减少及病态造血为特点,但MDS异质性非常明显,大部分患者呈现慢性、良性的病程,而高危患者可转化为急性白血病,预后极差。促进MDS转化为急性白血病的机制未明,近年来研究表明,同源异型基因 SALL4表达失衡可增加CD34+造血干细胞/祖细胞的增殖能力而促进白血病的发生[ 1],另外一种干细胞转录因子Nanog则抑制p53表达并与正常细胞向肿瘤细胞转化有关[ 2, 3]。MDS作为“白血病前期”,造血干细胞具有不断演变的特点,本研究对各亚型MDS患者外周血及骨髓有核细胞 SALL4 mRNA和 Nanog mRNA的表达情况进行了检测,以初步探讨MDS患者 SALL4 mRNA和 Nanog mRNA表达的临床意义。
标本来源于复旦大学附属金山医院肿瘤血液中心2007年6月至2012年6月收治的75例MDS患者。所有患者均经细胞形态学、免疫学、遗传学或分子生物学确诊,按2008年第4版《WHO classification of tumours of haematopoietic and lymphoid tissues》重新确认分型,其中难治性血细胞减少伴单系病态造血(RCUD)11例,难治性贫血伴环状铁粒幼红细胞(RAS)2例,难治性血细胞减少伴多系发育异常(RCMD)29例,难治性贫血伴原始细胞增多(包括RAEB-I和 RAEB-II)28例,不能分类者(MDS-U)5例。男41例,女34例,年龄21~76岁。对照组30名,男18名,女12名,年龄31~59岁,为健康体检人群。
Trizol试剂为美国Invitrogen公司产品,红细胞裂解液购自无锡碧云天生物试剂公司,Prime-Script RT逆转录试剂盒及SYBR Premix Ex Taq荧光定量聚合酶链反应(polymerase chain reaction, PCR)试剂盒均购自日本Takara公司,荧光定量PCR仪为德国Eppendorf公司产品(MasterCycler Realplex4 system)。引物由Invitrogen公司合成。
外周血标本:抽取静脉血2 mL,置经乙二胺四乙酸(elhylene diamine tetraacetic acide, EDTA)处理的15 mL无酶离心管内;骨髓标本:抽取2~3 mL骨髓,立即置经EDTA处理的15 mL无酶离心管内。于30 min内进行以下操作:在离心管内加入3 mL红细胞裂解液,轻轻振荡混匀后静置10 min,室温470× g离心5 min,弃上清。重复裂解红细胞1次,加入1 mL Trizol试剂置-70 ℃保存以备提取总RNA。
采用Trizol-氯仿-异丙醇方法提取标本总RNA,所提取的总RNA经紫外分光光度仪测定总RNA含量及260和280 nm处吸光度( A)值,260和280 mm A值在1.80以上者用于后续试验。每份标本取总RNA 1 μg,按照产品操作说明,以20 μL体系逆转录为cDNA。
荧光定量PCR:登陆GenBank查询 SALL4 cDNA序列,根据引物设计原则设计各目的基因扩增引物, SALL4上游引物5'-CAGCACATCAACTCGGAGGAGGAGG-3',下游引物5'-ACTCAGAGATGCTGAAGAACTC-3',扩增产物282 bp; Nanog上游引物5'-CAGCTGTGTGTACTCAATGATAGA-3',下游引物5'-ACACCATTGCTATTCTTCGGCCAG- 3',扩增产物179 bp;内参GAPDH上游引物5'-GGTGGTCTCCTCTGACTTCAACA-3',下游引物5'-GTTGCTGTAGCCAAATTCGTTGT-3',扩增产物127 bp。反应条件为95 ℃ 30 s 预变性,95 ℃ 5 s,60 ℃ 30 s,共40个循环。反应体系为20 μL,每份标本均设3孔检测。
使用SPSS 16.0软件进行统计分析。mRNA表达变化以ΔΔCt作为统计量,符合正态分布和方差齐性的数据2组内比较采用独立样本 t检验,多组内比较采用单因素方差分析,不符合正态分布和方差齐性的数据则进行秩和检验。分类资料比较采用 χ2检验。 SALL4 mRNA和 Nanog mRNA表达(ΔΔCt)关系进行线性相关分析。 P<0.05为差异有统计学意义。
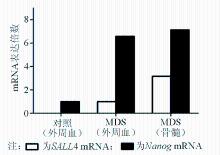
30名正常对照外周血有核细胞均无 SALL4表达,75例MDS患者中,39例外周血有不同强度的 SALL4表达,有36例 SALL4不表达。MDS患者 SALL4 表达明显高于正常对照( χ2=22.92, P<0.01)。MDS患者骨髓标本的 SALL4表达明显高于外周血标本( Z=5.60, P<0.01),所有MDS患者骨髓中均可见 SALL4表达。75例MDS患者及正常对照外周血均可见 Nanog表达,但各亚型MDS患者表达明显高于正常对照( F=88.78, P<0.01)。而且,MDS患者 Nanog在骨髓中的表达水平与外周血基本相仿( t=0.898, P=0.371),见图1:
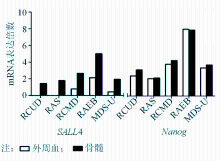
MDS各亚型之间在外周血和骨髓中的 SALL4与 Nanog表达均有明显差异,见图2。其中外周血有核细胞 SALL4的表达几乎均局限于RAEB-Ⅰ和RAEB-Ⅱ 2个亚型,其余亚型少见表达( χ2=43.59, P<0.01);骨髓中 SALL4表达在各亚型之间同样差异明显( F=15.98, P<0.01);外周血和骨髓中 Nanog的表达在不同MDS亚型患者之间均差异明显(外周血 F=27.47, P<0.01;骨髓 F=23.92, P<0.01),以RAEB-Ⅰ和RAEB-Ⅱ 2个亚型患者表达最强。另外, SALL4 与 Nanog在骨髓中的表达呈现一定的相关性( r=0.58, P<0.01)。
75例MDS患者中,共有7例患者转化为急性髓性白血病,其中5例为 RAEB-Ⅱ亚型,1例为RAEB-Ⅰ亚型,另外1例为RCMD亚型。虽然例数较少,但这些患者无论是外周血还是骨髓,其 SALL4 mRNA和 Nanog mRNA的表达均高于其他患者( SALL4 外周血 t=2.27, P<0.05;骨髓 t=2.85, P<0.05。 Nanog外周血 t=5.20, P<0.01;骨髓 t=5.51, P<0.01)。
原癌基因 SALL4是一类在进化过程中高度保守的基因。在正常骨髓CD34+造血干细胞/祖细胞中表达,而随原始细胞的分化成熟,其表达下调,对维持胚胎干细胞的多向潜能和自我更新有着重要作用[ 2]。 SALL4作为调节生长发育的转录因子,可与其他造血调控因子共同作用于造血过程,影响白血病的发生和发展。本研究对 SALL4与血液病中MDS的关系进行了初步研究,结果显示MDS患者 SALL4 表达明显高于正常对照,但有部分患者外周血始终未能诱导出 SALL4 表达,而患者骨髓中则均表达 SALL4且明显高于外周血标本。由此可见, SALL4在外周血表达量较小,而骨髓由于含有较多的造血干细胞,对 SALL4检测的敏感性明显增高。Lin等[ 3]最新的研究表明,MDS患者 SALL4表达的升高可能源于基因的低甲基化。
2003年,Chambers等[ 4]和Mitsui等[ 5]几乎同时报道了一种在囊胚内细胞群、原始生殖细胞以及ESCs表达的新转录因子,将该基因命名为 Nanog。 Nanog除了有助于胚胎干细胞自我更新和维持其未分化状态,还可促进细胞增殖[ 6]。 Nanog在癌细胞中的表达及其与p53之间的相互作用提示 Nanog的表达与体细胞向癌细胞转化有关[ 7]。我们通过对 Nanog在MDS中的变化以及其在疾病不同状态下的表达研究,发现虽然 Nanog的表达方式与 SALL4有所区别,但其表达亦明显高于正常对照,表明 Nanog和 SALL4在MDS的发生、发展中同样密切相关。 SALL4 与 Nanog在骨髓中的表达量呈现一定的相关性,提示在MDS疾病的发展过程中, SALL4 与 Nanog具有同步变化的特点,二者可能共同参与了促进造血干细胞恶变的机制。
无论是在外周血和骨髓中, SALL4 和 Nanog的表达在MDS各亚型之间均存在明显差异:RAEB-I和RAEB-Ⅱ 2个亚型中 Nanog和 SALL4的表达明显高于其他亚型,这与RAEB-I和RAEB-II亚型体内原始细胞数量明显升高相一致。王华等[ 8]运用逆转录PCR已经证实急性白血病患者高表达 SALL4,其中以急性髓性白血病患者表达更为明显,而本研究相应地发现,在7例转化为急性髓性白血病的MDS患者中,其确诊MDS时的外周血及骨髓的 SALL4和 Nanog表达明显高于其他患者,提示MDS患者中 Nanog和 SALL4的表达可能从另外一个侧面反映白血病细胞的负荷,对疾病的转归具有一定的预测意义。 SALL4和 Nanog均与正常造血干细胞向白血病干细胞转化密切相关,二者是否具有协同作用有待于进一步研究。深入了解 SALL4和 Nanog的作用将有助于探讨MDS的发病机制及其各亚型之间在分子生物学水平上的差别,并为今后更准确地诊断和靶向治疗恶性血液病提供潜在的新途径。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|