作者简介:黄晓春,女,1984年生,学士,主要从事临床微生物学检验工作。
通讯作者:秦阳华,联系电话:021-31162077。
评价VITEKx0dbc0;x0ddbf;2COMPACT全自动细菌鉴定仪(简称VITEK 2C)和AST-GN13卡检测鲍曼不动杆菌对阿米卡星体外敏感性的性能。
方法采用微量肉汤稀释(BMD)法、Kirby-Bauer纸片扩散(KB)法和VITEK 2C分别检测38株临床分离的鲍曼不动杆菌对阿米卡星的敏感性,以BMD法为参比方法,评价VITEK 2C和KB法的性能。通过多重聚合酶链反应(PCR)扩增鲍曼不动杆菌氨基糖苷修饰酶基因以研究其耐药基因型。
结果以BMD法为参比方法,VITEK 2C和AST-GN13卡检测鲍曼不动杆菌对阿米卡星的敏感性时19株菌株(50.0%)出现重大误差,2株(5.3%)出现次要误差。多重PCR结果也显示鲍曼不动杆菌氨基糖苷修饰酶基因型和BMD法结果一致。
结论VITEK 2C在检测鲍曼不动杆菌对阿米卡星的敏感性时有局限性,需要采用KB法替代检测。
To evaluate the performance of VITEKx0dbc0;x0ddbf; 2 COMPACT automatic bacterial identification system(VITEK 2C) plus AST GN-13 for the susceptibility of
Three methods [broth microdilution(BMD), Kirby-Bauer(KB), and VITEK 2C] were used to determine the susceptibility of amikacin to 38 clinical isolates of
Comparing BMD as the reference method, VITEK 2C plus AST-GN13 yielded major errors in 19 isolates (50.0%) and minor errors in 2 isolates (5.3%). Multiple PCR results of aminoglycoside-modifying enzyme gene were consistent with the results of BMD.
ConclusionsThe VITEK 2C has limitations, which requires that KB should be used for the susceptibility of
随着抗菌药物以及免疫抑制剂的广泛使用,鲍曼不动杆菌( Acinetobacter baumannii)特别是多重耐药和泛耐药鲍曼不动杆菌引起的感染在临床上越来越常见。快速、准确的鉴定和药物敏感性试验是患者治疗、医院感染控制的前提和关键。目前临床上通常采用全自动细菌鉴定和药物敏感性检测仪进行细菌鉴定和药物敏感性试验,如法国生物梅里埃公司VITEKx0dbc0;x0ddbf; 2 COMPACT全自动细菌鉴定仪(简称VITEK 2C)结合其微生物鉴定药物敏感性智能专家系统,能在较短时间内(6 h)完成检测,极大地缩短了临床微生物检测周期。但较短的孵育时间也带来了一些检测结果不确定的风险,有文献报道检测鲍曼不动杆菌对阿米卡星的敏感性,当检测出最低抑菌浓度(minimum inhibitory concentration,MIC)为8或16 x003bc;g/mL时需要采用其他替代方法如纸片药物敏感性试验进行测试[ 1, 2]。我们在临床工作中发现部分鲍曼不动杆菌对阿米卡星采用AST-GN13卡在VITEK 2C上检测结果为4或x02264;2 x003bc;g/mL,而临床应用阿米卡星治疗效果不佳,采用纸片药物敏感性试验检测时发现呈现双圈抑制,往往为高度耐药(抑菌圈直径6 mm)。为了评价VITEK 2C检测鲍曼不动杆菌对阿米卡星MIC的准确性,我们做了系统研究。
2012年第3季度长海医院临床分离38株鲍曼不动杆菌,均经革兰染色显微镜下形态观察为革兰阴性球杆菌,克氏双糖管不分解乳糖和葡萄糖,41和44 ℃生长,VITEK 2C GN卡鉴定为鲍曼复合群。
1.药物敏感性试验
采取3种方法检测鲍曼不动杆菌对阿米卡星的敏感性:(1)采用AST-GN13卡(法国生物梅里埃公司)在VITEK 2C上测定,操作根据仪器操作规程进行,AST-GN13卡上阿米卡星共有3个浓度,分别为8、16和64 x003bc;g/mL, 报告浓度范围为x02264;2~x02265;64 x003bc;g/mL;(2)采用Kirby-Bauer纸片扩散(KB)法,药物敏感性纸片含阿米卡星30 x003bc;g(英国OXOID公司),采用标准菌株大肠埃希菌(ATCC 25922)和铜绿假单胞菌(ATCC 27853)对KB法进行质量控制。药物敏感性试验步骤按照美国临床实验室标准化协会(Clinical and Laboratory Standards Institute,CLSI)文件(M02-A11、M100-S22)标准进行;(3)采用微量肉汤稀释(broth microdilution,BMD)法测定阿米卡星体外抑制鲍曼不动杆菌的MIC。采用阳离子调整的Mueller-Hinton肉汤(英国OXOID公司)根据CLSI M07-A9文件进行检测,阿米卡星药物浓度范围为0.5~512 x003bc;g/mL共11个浓度梯度。
体外药物敏感性试验结果根据CLSI M100-S22[ 3]进行判断,MICx02264;16 x003bc;g/mL敏感,MICx02265;64 x003bc;g/mL耐药,MIC=32 x003bc;g/mL为中敏,KB法直径x02265;17 mm敏感,直径x02264;14 mm耐药,介于两者之间为中介。
2.氨基糖苷修饰酶基因检测
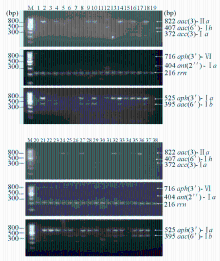
(1)模板DNA的提取:用1 x003bc;L接种环挑取一环麦康凯平板上生长的单个菌落,混悬于含有灭菌蒸溜水250 x003bc;L的Eppedorf管中, 100 ℃加热15 min,以12 000x000d7; g离心10 min,上清即模板DNA,分装后-20 ℃保存;(2)PCR扩增:氨基糖苷修饰酶基因引物序列根据文献[1,4]合成,具体序列见表1。8对引物分3管进行多重PCR扩增, 试剂采用大连TaKaRa公司预混PCR反应液。多重PCR1扩增氨基糖苷乙酰转移酶(aminoglycoside acetyltransferases,AAC)基因 aac(3)-x02160; a, aac(3)-x02161; a, aac(6')-x02160; h);多重PCR 2扩增氨基糖苷磷酸转移酶(aminoglycoside phosphotransferase,APH)基因 aph(3')-x02165;)、氨基糖苷腺苷转移酶(aminoglycoside adenyltransferase,ANT)基因 ant(2'')-x02160; a和内部质控16S RNA片段( rrn);多重PCR3扩增APH基因 aph(3')-x02160; a和AAC基因 aac(6')-x02160; b。反应条件为95 ℃预变性5 min;95 ℃变性30 s,49 ℃(多重PCR 1和2),55 ℃(多重PCR 3)退火60 s,72 ℃延伸60 s,30个循环,最后72 ℃延伸5 min。PCR产物采用2.0%琼脂糖凝胶电泳,GelRed(美国Biotium公司)染色后,紫外线照射观察结果并拍照。
| 表1 氨基糖苷修饰酶基因PCR引物序列 |
不同药物敏感性试验之间以及鲍曼不动杆菌基因型和表型之间的比较采用GraphPad Prism 5软件进行 x003c7;2检验, P<0.05为差异有统计学意义。
38株鲍曼不动杆菌临床分离株来自全院各科室,风湿科、普外科、神经内科、消化科和血液内科各1株,其余33株均来源于重症监护室(烧伤科监护室9株、胸外科监护室15株、脑外科监护室3株、急救科监护室6株),分布较为集中,患者大多接受过气管插管或切开及机械通气治疗。其中27株分离于痰液标本,4株分离于血液标本,5株分离于伤口分泌物标本,2株分离于清洁中段尿标本。
3种体外药物敏感性试验检测鲍曼不动杆菌对阿米卡星的敏感性结果见表2。BMD法、KB法和VITEK 2C检测鲍曼不动杆菌对阿米卡星的耐药率分别为71.1%、76.3%和18.4%。经统计分析BMD法和KB法检测结果之间差异无统计学意义( P=0.57),BMD法和VITEK 2C检测结果之间差异有统计学意义( P<0.01)。以BMD法为参比方法,KB法结果比较理想,一致率达到94.7%,1株结果出现重大误差(BMD法为敏感,MIC=4 x003bc;g/mL,而KB法因为抑菌圈内有小的菌落而判断为耐药),1株结果出现次要误差(BMD法为中介,MIC=32 x003bc;g/mL,而KB法抑菌圈内有小的菌落而判断为耐药);而VITEK 2C结果则误差较大,一致率只有44.7%,19株结果出现重大误差(BMD法为高度耐药,而VITEK 2C结果为敏感,MIC值为x02264;2、4 或8 x003bc;g/mL),2株结果出现次要误差(1株BMD法为耐药,而VITEK 2C结果为中介;另一株BMD法为中介而VITEK 2C结果为敏感)。
38株鲍曼不动杆菌氨基糖苷修饰酶检测结果见图1,具体基因型见表3。引起鲍曼不动杆菌对阿米卡星耐药的主要基因型为 aac(3) -x02161;a + aac(6 ') -x02160;b + aph(3 ') -x02160;a,表现为对阿米卡星高浓度耐药(MICx02265;512 x003bc;g/mL),对阿米卡星敏感的11株鲍曼不动杆菌中有4株检测出不同氨基糖苷修饰酶基因。
以BMD法为参照,VITEK 2C检测阿米卡星MIC出现误差的鲍曼不动杆菌氨基糖苷修饰酶基因型分布见表4。最多的基因型为 aac(3) -x02161;a+aac(6 ') -x02160;b+aph(3 ') -x02160;a,共有11株(7株MIC值为4 x003bc;g/mL,4株MIC值为8 x003bc;g/mL)。
| 表2 3种药物敏感性试验检测38株鲍曼不动杆菌的结果比较 |
注:M为100 bp ladder DNA Marker;1~38泳道分别是38株鲍曼不动杆菌氨基糖苷修饰酶基因检测结果
| 表3 38株鲍曼不动杆菌氨基糖苷酶基因分型 |
| 表4 VITEK 2C和BMD法检测结果不符的21株鲍曼不动杆菌基因型 |
氨基糖苷类抗菌药物临床应用迄今已有50多年,因其具有浓度依赖性快速杀菌作用,与x003b2;-内酰胺类抗菌药物联合使用可提高抗菌作用,广泛用于革兰阴性杆菌所致的败血症、感染性心内膜炎和其他严重感染。随着抗菌药物以及免疫抑制剂的广泛使用,鲍曼不动杆菌引起的感染在临床上越来越常见。医院感染病原菌中鲍曼不动杆菌分离率一直处于前列,是引起医院感染的主要病原菌之一。随着多重耐药和泛耐药鲍曼不动杆菌的出现和在临床蔓延,其诊断和治疗也越来越受到医生、感染控制专家和检验人员的重视。本研究显示,VITEK 2C在检测鲍曼不动杆菌对阿米卡星的敏感性时出现了误差,主要表现为MIC结果为敏感范围内而采用其他方法(KB法、BMD法)结果则为耐药,PCR检测氨基糖苷类耐药基因也提示含有耐药基因,说明采用VITEK 2C检测鲍曼不动杆菌对阿米卡星的敏感性存在不准确性,需要用其他方法进行检测。
我们首先分别采用3种方法检测38株临床分离的鲍曼不动杆菌对阿米卡星的敏感性,结果显示KB法和BMD法之间有很好的一致性,而VITEK 2C检测结果与BMD法之间存在差异,主要表现为VITEK 2C自动检测MIC值4或x02264;2 x003bc;g/mL,而BMD法检测却显示为高度耐药(x02265;512 x003bc;g/mL)。
鲍曼不动杆菌对氨基糖苷类药物耐药主要是产生氨基糖苷修饰酶,包括APH、AAC、ANT。被修饰后的药物与核糖体氨酰-tRNA的亲和力大大减弱,失去了干扰细菌蛋白质合成的能力,使细菌对氨基糖苷类药物产生抗性。我们采用PCR检测氨基糖苷类耐药基因,证明出现误差的21株菌株均检测出耐药基因,大多数含有2个以上的耐药基因,最常见的基因型为 aac(3) -x02161;a+aac(6 ') -x02160;b+aph(3 ') -x02160;a。
造成VITEK 2C检测出现误差的原因可能是因为在鲍曼不动杆菌中对阿米卡星存在诱导性耐药。采用KB法检测时发现阿米卡星纸片周围出现了双圈耐药现象,即抑菌圈与纸片之间出现了一个生长圈。国内外不少文献对双圈耐药现象进行了研究,发现主要由于鲍曼不动杆菌通过x02160;类整合子获得AAC耐药基因,并且该耐药基因可以被阿米卡星诱导而表达增加[ 5, 6, 7, 8, 9]。经过连续传代双圈耐药现象会消失,说明诱导表达的耐药基因可以转变为组成性表达。由于 VITEK 2C检测周期短,鲍曼不动杆菌药物敏感性试验检测时间为6~8 h,并且可诱导耐药基因表达依赖特定浓度范围的阿米卡星,从而造成了检测值偏低。
本研究针对VITEK 2C检测鲍曼不动杆菌对阿米卡星敏感性出现误差的现象,检测了鲍曼不动杆菌中氨基糖苷类耐药基因的存在情况,并探讨了出现误差的可能原因,提示目前鲍曼不动杆菌药物敏感性试验结果为多重耐药而对阿米卡星的耐药性检测显示为敏感的可以改用KB法结果替代。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|