作者简介:张蓉,女,1970年生,学士,副主任医师,主要从事免疫学和分子生物学研究。
表皮生长因子受体(epidermal growth factor receptor, EGFR)属于酪氨酸激酶受体,其介导的信号转导途径调节细胞的生长、增殖和分化。在癌变的细胞株中发现EGFR 酪氨酸激酶区常发生各种突变,这些突变和酪氨酸激酶抑制剂(tyrosine kinase inhibitors,TKIs)的疗效密切相关。2004 年Paez 等[ 1]和Lynch等[ 2] 首先报道了TKIs对EGFR发生激活突变的非小细胞肺癌(non-small cell lung cancer,NSCLC)患者具有明显的疗效,且女性、非吸烟者、腺癌患者、亚洲人更容易发生EGFR激活突变。近年来,以吉非替尼(gefitinib)和厄罗替尼(erlotinib)为代表的EGFR-TKIs已成为晚期NSCLC靶向治疗的热点。2011年 “中国肺癌高峰共识会”的与会专家一致认为,具有EGFR突变的NSCLC在生物学行为、治疗策略、临床预后等方面完全有别于没有EGFR突变的肺癌,应将其从目前的肺癌分类中独立出来而成为“EGFR 突变型肺癌”[ 3]。本研究通过对Ⅲ期临床随机对照试验的更新资料进行Meta分析,评估EGFR-TKIs或标准化疗药物一线治疗EGFR突变型晚期NSCLC的功效。
在PubMed和Embase数据库中查找相关英文文献。检索式为:(lung cancer OR NSCLC) AND (epidermal growth factor receptor OR EGFR) AND (mutation*) AND (tyrosine kinase inhibitor OR TKI)。由2位研究者(有执业资质的副主任和主任医师)分别阅读和筛选检索得到的所有摘要,达成一致后获取相关摘要的全文,并进一步浏览各相关文献和综述的参考文献及引文目录,以寻找其他相关文献。另外,还检索了重大肿瘤学术会议论文集和学位论文等。为尽量保持纳入文献的同质性,制定文献的纳入标准为:(1) 2004年1月至2012年3月发表的英文文献;(2)研究对象为以前未化疗的NSCLC患者,EGFR突变阳性(主要为外显子19的缺失突变或外显子21上的L858R替代突变);(3) 干预组以吉非替尼或厄罗替尼为一线治疗药物;(4) 对照组一线常规化疗;(5) 文中提供了中位无进展生存时间(progression-free survival,PFS)和/或总生存期(overall survival,OS) 数据; (6) 随机对照的Ⅲ期临床试验;(7) 当2个或多个研究涉及重复研究对象时,取最新发表的数据;(8)各研究中病例组和对照组的基因型分布进行Hardy-weinberg遗传平衡检验符合Hardy-weinberg平衡。
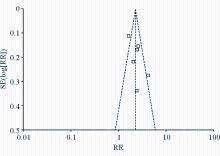
采用Cochrane协作网提供的RevMan 5.1统计软件。对总有效率(overall response rate,ORR)计数资料选择相对危险度( risk ratio,RR)作为效应尺度指标,所有时间到事件数据(PFS、OS)用方差倒数和随机效应模型合并和计算风险比(hazard ratio,HR),同时计算95%可信区间(confidence interval, CI)。使用方差倒数法需要有每项研究的效应估计值和标准误,如未能从试验报告中直接获得此数据,参照Tierney等的方法计算[ 4]。RR>1 表示试验组的效应量大于对照组,而HR < 1 反映试验组的效应大于对照组。数据间异质性通过 Q检验和 I2评估 ,当 Q检验 P<0.1 且 I2>50%时认为研究间存在异质性。试验药物( 吉非替尼和厄罗替尼)效应之间行亚组分析。假设检验采用 χ2检验, P<0.05表示差异有统计学意义。绘制漏斗图和计算失效安全系数(fail-safe number, Nfs)以评价是否存在偏倚。
纳入文献中符合标准的文献7篇[ 5, 6, 7, 8, 9, 10, 11],共6项研究,1 030例研究对象。 表1列出所有纳入文献的一般资料。另外11篇Ⅲ期临床试验文献被排除的原因包括:(1) 试验组TKIs为2线治疗[ 12, 13, 14, 15](4篇)或为TKIs联合化疗[ 16, 17, 18, 19](4篇);(2) 对照组使用安慰剂而非标准化疗[ 20, 21, 22] (3篇)。
从6项研究中提取有效数据,EGFR突变者为1 030例,其中42例未报告突变类型。988例中,外显子19缺失突变者占54.8%,外显子21 L858R点突变者占42.8%,其他突变者占2.4%。
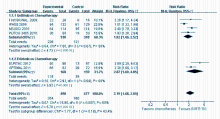
EGFR-TKIs 组ORR为71.1% (354/498),明显高于化疗组33.5% (160/477),差异有统计学意义 (RR =2.19,95% CI = 1.68~2.15, P<0.000 01);吉非替尼与厄罗替尼亚组比较差异无统计学意义( χ2 = 1.77, P= 0.18),见 图1。
EGFR-TKIs组的中位PFS为8.4~13.1个月,化疗组为4.6 ~ 6.7个月。2组比较,EGFR-TKIs组PFS长于化疗组,差异有统计学意义(HR=0.43,95% CI=0.35~0.52, P< 0.000 01)。根据不同的TKIs(吉非替尼或厄罗替尼)分别与相应化疗组进行亚组分析,吉非替尼或厄罗替尼亚组PFS均长于化疗组,差异有统计学意义(HR=0.43,95% CI=0.32~0.58; P<0.000 01 和 HR=0.43,95% CI=0.33~0.55; P<0.000 01)。而吉非替尼与厄罗替尼间比较差异无统计学意义( χ2 = 0.00, P=0.97),见 图2。
EGFR-TKIs组的OS中位数范围为19.3~30.9个月,化疗组为19.5~30.5个月。2组OS差异无统计学意义(HR = 0.98,95% CI=0.81~1.18, P=0.80),见 图3。
通过对1 030例EGFR突变的晚期NSCLC患者一线EGFR-TKIs或铂类为基础的双重化疗资料Meta分析,得出如下结论:首先,接受EGFR-TKIs治疗的患者ORR明显高于接受化疗者;其次,EGFR-TKIs治疗与化疗相比明显改善PFS;第三,2组相比OS差异无统计学意义。OS的结果可能被一些情况混淆,如较高比例患者接受了不同类型后续治疗,尤其是药物的交叉治疗。另外,与化疗相比,接受TKIs一线治疗的患者有较好的与健康相关的生活质量和较低的毒性反应[ 24]。
EGFR是目前国内、外研究者公认的一项肿瘤靶向治疗分子。目前靶向EGFR的药物主要有2类:一类是作用于EGFR胞外区的单克隆抗体,这类抗体能与EGFR胞外配体结合部位结合,阻断EGFR与其配体的结合,从而阻断下游信号转导途径;另一类是作用于胞内酪氨酸激酶活性区域的TKIs,如吉非替尼和厄罗替尼。TKIs主要为小分子喹啉类化合物,能够与细胞内酪氨酸激酶结构域上三磷酸腺苷位点竞争性结合,可逆性、选择性地抑制EGFR相关的酪氨酸激酶活性及细胞内磷酸化过程,进而抑制EGFR下游的信号转导,从而阻断EGFR诱导的体外肿瘤细胞的生长,加速细胞凋亡、拮抗血管生成、抑制肿瘤转移、阻断肿瘤生长[ 25]。Paez 等[ 1]和Lynch等[ 2]率先报道了肺癌细胞中EGFR 酪氨酸激酶活化致编码区基因突变是靶向药物治疗奏效的一个必要的前提条件。NSCLC 中,EGFR 突变可发生在外显子18~21区,常见为外显子19的缺失突变或外显子21上的L858R替代突变。IPASS[ 6]、WJTOG3405[ 8]和NEJ002[ 9]3个吉非替尼一线治疗晚期NSCLC的研究结果显示,外显子19缺失和21外显子L858R突变亚组间比较PFS差异无统计学意义。
基于Ⅲ期随机对照试验的结果,国外建议考虑使用EGFR-TKIs一线治疗(以前没有接受化疗或EGFR-TKIs治疗)的NSCLC患者应该进行EGFR突变检测,以确定是否一线使用EGFR-TKIs治疗或化疗[ 26]。国内推荐对EGFR突变型晚期NSCLC 一线使用EGFR-TKIs,直至疾病进展或毒性不能耐受;对于EGFR 突变状态未知的患者,不推荐一线使用EGFR-TKIs[ 3]。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|