作者简介:唐立萍,女,1965年生,副主任技师,主要从事临床生化质量控制工作。
载脂蛋白A1(apo A1)、载脂蛋白B(apo B)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)、胆固醇(CHOL)及甘油三酯(TG)是临床生化脂质代谢检验的最常用的检验项目。对高血脂症的筛选是针对心血管危险因素的常规检查,具有重要的临床检测价值。为保证检测结果的准确性和可靠性,实验室应通过室内质量控制(IQC)系统,使用质控品,确立质控标准,间接评价检测结果的精密度,同时结合室间质量评价(EQA)间接评价检测结果的准确性。但目前我国所用的多为国外进口质控品,面临价格昂贵、入关难等问题。因此,我们研制了一种液体非定值血脂质控品,采用混合人血清为基质,可替代人血清用于临床实验室的日常IQC以及进行不同实验室之间的EQA和检测结果一致性调查使用。
1.仪器和试剂 日立7180全自动生化分析仪。HDL-C、LDL-C、CHOL、TG试剂盒由日本和光(Wako)纯药工业株式会社提供。apo A1、apo B试剂盒由罗氏诊断产品(上海)有限公司提供。
2.校准品 采用罗氏多项目校准品(c.f.a.s)、罗氏脂类多项校准品(c.f.a.s lipids)和Wako复合脂类校准品。
3.参考质控品 Bio-Rad血脂调查品。
4.主要原材料 人类免疫缺陷病毒(HIV)抗体、丙型肝炎病毒(HCV)抗体、乙型肝炎表面抗原(HBsAg)阴性的混合人血清,叠氮钠,稳定剂。液体apo A1抗原、apo B抗原、HDL-C、LDL-C、CHOL及TG成分由上海北加生化试剂有限公司提供。
选取HIV抗体、HCV抗体、HBsAg均阴性的血清混合,储存于-80 ℃冻存备用。取洁净50 mL量筒及250 mL三角烧瓶各2个,用工艺用水冲洗3次,置37 ℃,烘干。按需量取上述备用人血清,检测各成分浓度。按需添加apo A1抗原、apo B抗原、HDL-C、LDL-C、CHOL及TG等成分。经核对无误后,放入容器内,添加万分之二叠氮钠及稳定剂。将容器用薄膜密闭封口,上下左右轻轻振摇10 min,重复3次,每次间隔10 min,混匀。检测中间品各成分,确定检测值是否与预期值相符合(允许偏移≤15%)。用0.22 μm孔径的硝酸纤维素滤膜抽滤,分装,每瓶分装1 mL,各分装50瓶。置-20 ℃保存。
校准仪器系统,所需检测项目试剂重新定标。
使用Bio-Rad血脂调查品做IQC。
1.精密度 取同批号的在-20 ℃密闭保存的自制质控品11瓶,每瓶检测1次,计算测定结果的均值( 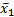
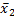
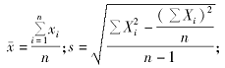
s瓶间 = 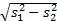
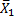
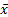
2.储存稳定性 质控品制备后各项目分别检测2次,计算 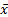
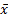
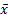
3.开瓶稳定性 取在-20 ℃密闭保存的质控品,开封后置2~8 ℃密闭存放,每天检测2次,取 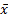
各项目精密度应≤1/4 CLIA’88可接受性能指标,即apo A1、apo B、HDL-C、LDL-C的 CV≤7.5%。CHOL的 CV≤2.5%,TG的 CV≤6.25%。检测结果见 表1。质控品各项目瓶间差均符合要求。
| 表1 自制质控品各项目精密度(瓶间差) |
1. 储存稳定性 偏移结果应符合1/2美国 CLIA’88可接受性能指标规定,即apo A1、apo B、HDL-C、LDL-C的偏移≤±15%,CHOL的偏移≤±5%,TG的偏移≤±12.5%。自制质控品-20 ℃保存18个月,各项指标的稳定性均符合要求。结果见 表2。
| 表2 自制质控品-20℃保存第1个月与第4、11、13、14、16及18个月结果比较 |
2.开瓶稳定性 各项目 CV应≤1/4 美国CLIA’88可接受性能指标,即apo A1、apo B、HDL-C、LDL-C的 CV≤7.5%,CHOL的 CV≤2.5%,TG的 CV≤6.25%。自制质控品开瓶后连续检测19 d,各项目 CV均符合要求。结果见 表3。
| 表3 自制质控品开瓶后连续检测19 d结果 |
随着社会经济的发展,生活水平的提高和生活方式的变化,我国血脂异常人群已达到1.6亿[ 1]。大量研究表明血脂异常是心血管疾病和缺血性脑卒中发病的重要危险因素。因此,临床工作中经常采用血脂指标评估相关疾病的发病风险,如TG、CHOL、LDL-C、HDL-C、apo A1、apo B等[ 2]。
为保证检测结果的可靠性,IQC和EQA是质量管理体系中一个重要环节,其控制着整个实验流程,如样本吸取、样本测定、结果分析等,是保证高质量操作的必要措施[ 3]。质控品是保证室内质控工作顺利进行的重要物质基础。随着医学检验质量控制的开展和深入,生产质控品的单位日益增多,合格的质控品应具有分析物稳定、均一、瓶间差异小、合理的分析物浓度和掺入成份对测定无干扰等特性,其中分析物的稳定性是评价质控品优劣的首要指标。
目前血脂指标有多种测定试剂及方法,各试剂方法间测定的敏感性及不精确度不同,样本采集后,由于细胞的代谢活动、化学反应、微生物降解、渗透作用、光学作用等,都将直接或间接地影响到分析结果的准确性[ 4]。但受多种因素的影响,特别是试剂的质量不一,不同厂家的质控品稳定性不一致,无论选用哪种均应满足稳定性好、基质效应小的要求。而进口质控品价格比较昂贵,入关较难。本研究采用混合人血清(HIV抗体、HCV抗体、HBsAg阴性)为基质,自制了液体非定值血脂质控品,可替代人血清用于临床实验室的IQC以及进行不同实验室之间的(EQA)和检测结果一致性调查使用。我国目前尚无血脂质控品的国家或行业标准,因此参考临床实验室质量控制现行主要评价方法,以美国CLIA’88可接受性能指标为实验室EQA评价指标,以1/2 CLIA’88可接受性能指标为实验室IQC评价指标。制订以1/4 美国CLIA’88可接受性能指标为本质控品精密度技术指标,以1/2美国 CLIA’88可接受性能指标为本质控品稳定性技术指标。本研究中自制质控品的6项检测指标精密度均符合1/4 美国CLIA’88可接受性能指标。于-20 ℃密闭保存,连续18个月性能稳定,6项检测指标的偏移均<1/2美国CLIA’88可接受性能指标,符合要求。开瓶后于2~8 ℃密闭保存连续19 d,性能稳定,6项检测指标19 d的偏移均<1/4美国 CLIA’88可接受性能指标,精密度较好。本研究同时将Bio-Rad血脂质控品(进口)水平1和水平2进行了比较试验,自制质控品精密度与之相似。开瓶后于2~8 ℃密闭保存可稳定19 d,长于Bio-Rad血脂质控品说明书中的14 d。Bio-Rad血脂质控品-20 ℃密闭保存可稳定约2年,而本研究自制质控品连续18个月性能稳定,至于更长时间的稳定性情况需作进一步研究。由于时间、实验条件等限制,本研究自制质控品在不同仪器、不同试剂(方法)等的测定特性还有待进一步研究、完善。
综上所述,本研究自制质控品均匀性、稳定性都能满足要求,且有原料来源方便,价格便宜之优势,有利于开展IQC和EQA,提高检测质量。为国内相关诊断试剂产业的全面、健康发展,为临床实验室间最终实现结果的准确、可比性提供可行的实验技术支撑。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|

