作者简介:侯利丹,女,1988年生,硕士,主要从事肿瘤靶向治疗研究。
CD44是一种广泛分布于细胞表面的跨膜糖蛋白受体[ 1, 2]。其配体透明质酸(HA)是一种由D-N-乙酰氨基葡萄糖和D-葡萄糖醛酸为结构单元的高分子黏多糖,是细胞外基质的主要组成部分。据报道,CD44与HA结合,可介导细胞与细胞外基质黏附、淋巴细胞归巢等多种生理和病理过程[ 3, 4]。许多肿瘤细胞表面CD44高度表达,其在肿瘤的侵袭和转移过程中发挥重要作用。目前,已有许多学者以CD44为靶点分子,通过阻断CD44-HA结合从而降低肿瘤转移,进行肿瘤的靶向治疗。Zawadzki等[ 5]运用CD44s受体蛋白、CD44v10受体蛋白和CD44单克隆抗体阻断小鼠B16F10黑色素瘤CD44与其配体HA结合,发现在不进行任何其他处理的情况下,CD44s受体蛋白和CD44v10受体蛋白可使肿瘤在肺部的转移量分别降低70%和60%,CD44单克隆抗体也取得了基本相同的效果。近年来,随着纳米载药系统研究的兴起,纳米颗粒连接靶向分子HA,针对肿瘤细胞表面CD44进行肿瘤靶向治疗取得很大进展。Auzenne等[ 6]发现HA-PTX纳米颗粒对CD44阳性人卵巢癌细胞SKOV-3ip 和NMP-1的杀伤活性明显大于单纯PTX,加入过量游离的HA能够阻断这种增强的杀伤活性,提示HA-PTX通过靶向细胞表面CD44,达到增强杀伤细胞的效果。
虽然许多学者成功以CD44为靶点,HA为靶向分子,靶向杀伤肿瘤,提高药物疗效[ 7, 8]。但是,关于以CD44为靶点靶向杀伤肿瘤细胞的同时,是否会靶向杀伤高表达CD44的正常细胞这一问题,少有报道。研究显示CD44与HA的结合并不完全是自发的,不同活化状态的CD44与HA的结合活性不同,与CD44糖基化[ 9]、细胞类型[ 10]和HA自身状态[ 11] 等因素相关。许多肿瘤细胞如乳腺癌细胞、肺癌细胞表面CD44处于活化状态,不需要任何刺激因素即能自发结合HA[ 12]。正常细胞表面CD44处于何种状态,是否存在上述调控,目前仍未阐明。我们通过检测CD44与其天然配体HA的结合活性,探讨正常细胞和乳腺肿瘤细胞表面CD44的活化状态是否存在差异,旨在深入分析以HA为靶向分子,CD44为靶点进行肿瘤靶向治疗的可行性,明确HA是否选择性靶向肿瘤细胞表面CD44,而不靶向同样高表达CD44的正常细胞。
乳腺肿瘤细胞Hs578T、BT-549,正常小鼠胚细胞NIH3T3均购自中国科学院典型培养物保藏中心;分离20名正常人肝素钠抗凝血获取其外周血单个核细胞(peripheral blood mononuclear cells,PBMCs)。
RPMI1640培养液、DMEM培养液均购自GIBCO公司,淋巴细胞分离液购自上海华精生物高科技有限公司,PE标记的鼠抗人CD44单克隆抗体, PE标记的鼠抗人CD44同型对照抗体均购自eBioscience公司, PE/Cy5标记的鼠CD44单克隆抗体购自Abcam 公司,荧光标记的透明质酸(FL-HA)购自Calbiochem公司。
将Hs578T细胞在DMEM培养液(含10%胎牛血清、0.01 mg/mL牛胰岛素)中常规培养;BT-549细胞在RPMI1640培养液(含10%胎牛血清、0.023 U/mL牛胰岛素)中常规培养;NIH3T3细胞在含10%胎牛血清的DMEM培养液中培养。培养条件均为5%CO2、37 ℃,饱和湿度。所有实验细胞均取自对数生长期。
取正常人肝素钠抗凝血4 mL,加入等体积磷酸盐缓冲液(PBS)充分混匀,将其缓慢加入适量淋巴细胞分离液中,800× g水平离心15 min,小心吸取白膜层,用PBS 400× g离心10 min洗涤2遍,即获取人外周PBMCs。
分别取肝素钠抗凝血100 μL,加入2个流式专用管中,实验组加入适量CD44-PE单克隆抗体,阴性对照加入等体积CD44-PE同型对照抗体,轻轻混匀,室温避光孵育15~30 min后,在QPREP免疫学样品制备仪(COULTER公司生产)上处理血标本,流式细胞仪分析结果。0.25%胰酶分别消化处于对数生长期的NIH3T3细胞、Hs578T细胞和BT-549细胞,显微镜下观察。细胞呈单细胞悬液时用含血清的培养液终止消化,200× g离心5min,弃上清,再用适量PBS洗涤2遍计数,所有细胞均按每管约106个细胞的比例,收集至2个Eppendorf管中。NIH3T3细胞实验组加入适量鼠CD44单克隆抗体,乳腺肿瘤细胞实验组加入适量鼠抗人CD44单克隆抗体,对照组加入等体积CD44同型对照抗体,室温避光放置15~30 min,PBS洗涤2遍,500 μL PBS重悬,移至流式管中上机检测,收集10 000个细胞,荧光强度以对数放大,结果用CD44细胞的阳性率表示,数据用软件进行分析。
用Ficoll法分离获取2管人外周PBMCs,每管细胞数量约在106左右。0.25%胰酶分别消化处于对数生长期的小鼠胚细胞NIH3T3和乳腺肿瘤细胞Hs578T、BT-549,显微镜下观察。细胞呈单细胞悬液时用含血清的培养液终止消化,200× g,离心5 min,弃上清,再用适量PBS洗涤2遍,PBS重悬后计数,所有细胞均按比例收集于2个Eppendorf管中,每管约106个细胞。每种细胞均分为实验管和对照管,实验管加入40 μg/mL FL-HA 100 μL重悬,对照管加入100 μL培养液,37 ℃避光孵育2 h。然后用PBS洗涤2遍,移至流式管中,上机检测。
分别收集对数生长期的小鼠胚细胞NIH3T3和人乳腺肿瘤细胞Hs578T、BT-549,消化至单细胞呈单个悬液,接种到24孔培养板中,培养24~48 h,随机分为实验组和对照组,每组设双复孔,实验组加入40 μg/mL FL-HA 200 μL,对照组加入200 μL 培养液,37 ℃避光孵育1 h,PBS洗涤2遍,荧光显微镜下观察。
采用SPSS 13.0软件对数据进行统计分析,结果用 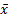
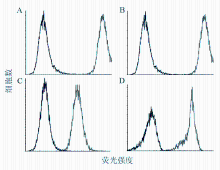
正常人PBMCs、NIH3T3细胞及Hs578T细胞、BT-549细胞均高表达CD44,见 图1。CD44细胞的阳性率分别为(99.57±0.31)%、(99.26±0.81)%、(99.85±0.21)% 和(99.99±0.10)%,各组间CD44表达差异无统计学意义( P>0.05)。
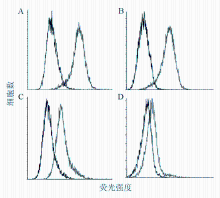
正常人PBMCs、NIH3T3细胞表面CD44与HA结合活性较低;乳腺肿瘤细胞Hs578T、BT-549表面CD44与HA结合活性较高,CD44处于活化状态,见 图2。CD44活化阳性率分别为(3.61±2.65)%、(14.33±1.35)%、(93.4±6.40)% 和(94.70±0.15)%,PBMCs、NIH3T3细胞与乳腺肿瘤细胞Hs578T、BT-549表面CD44活化差异有统计学意义( P<0.05),提示上述正常细胞表面CD44处于相对静止状态,乳腺肿瘤细胞表面CD44处于活化状态。
在荧光显微镜下观察可见,与FL-HA孵育后,NIH3T3细胞与对照组荧光强度无明显差异,表明FL-HA基本不与细胞表面CD44结合,无靶向作用,CD44处于相对静止状态;而乳腺肿瘤细胞Hs578T、BT-549与对照组相比,细胞表面发呈现出强绿色荧光,提示FL-HA与肿瘤细胞表面CD44高度靶向结合,CD44处于活化状态,见 图3。
近年研究发现,黏附分子CD44在许多恶性肿瘤细胞表面高度表达,如乳腺癌、结肠癌等。其与肿瘤的侵袭和转移密切相关,特别是与天然配体HA的结合在肿瘤恶性进展中的作用受到广泛关注[ 13]。目前已有学者运用HA、CD44单克隆抗体、CD44受体蛋白等阻断CD44与HA的结合,有效减小肿瘤体积,抑制肿瘤转移;以HA为靶向分子制作的药物通过结合靶点CD44有效地提高了药物在肿瘤部位的聚集,增加药物的生物利用度,达到靶向治疗肿瘤的效果。尽管许多学者已将肿瘤细胞表面高表达的CD44作为靶点进行肿瘤靶向治疗研究,但在HA-化疗药靶向结合肿瘤细胞表面CD44,提高药物对肿瘤细胞的杀伤效果的同时,机体许多正常细胞同样高表达CD44,是否能够免受靶向药物的杀伤,及其如何免受其杀伤的机制,目前少有研究。
本研究分析了正常人PBMCs、NIH3T3细胞和乳腺肿瘤细胞Hs578T、BT-549表面的CD44表达及其活化状态——即其与HA的结合活性。首先采用流式细胞术检测上述正常和肿瘤细胞表面CD44的表达水平,结果显示正常人PBMCs、NIH3T3细胞和乳腺肿瘤细胞Hs578T、BT-549均高表达CD44,阳性率在95%以上,验证了在正常细胞和肿瘤细胞表面CD44均存在高表达的现象。在此基础上,应用FL-HA通过流式细胞术检测CD44与HA的结合活性。结果显示正常人PBMCs、NIH3T3细胞表面CD44与HA结合的活性较低,分别为(3.61±2.65)%和(14.33±1.35)%;乳腺肿瘤细胞表面CD44与HA的结合活性远远高于正常人PBMCs和NIH3T3细胞,均高于90%。正常与肿瘤细胞表面CD44与HA的结合活性存在相对差异。
本研究进一步阐明了正常细胞和肿瘤细胞表面CD44的活化状态差异影响HA与其靶向结合的能力。NIH3T3细胞中加入FL-HA孵育后,荧光显微镜下观察显示NIH3T3基本无荧光,提示CD44处于相对静止状态,FL-HA与其靶向结合很弱。而肿瘤细胞表面呈现强绿色荧光,提示乳腺肿瘤细胞表面CD44处于活化状态,FL-HA与其有很强的靶向结合活性。这一现象说明以HA为靶向分子,以CD44为靶点制备抗肿瘤药物,药物能够选择性靶向高表达CD44的肿瘤细胞,有效提高药物对肿瘤的杀伤作用,但同样高表达CD44的正常细胞,由于CD44处于相对静止状态,与HA结合活性较低,药物对其无靶向及杀伤作用。这一结果提示,HA在靶向杀伤高表达CD44的肿瘤细胞时,机体高表达CD44的正常组织可以免受其杀伤。
综上所述,本研究初步发现了CD44分布于正常和肿瘤细胞上的活化状态不同。以HA为靶向分子、CD44为靶点进行肿瘤靶向治疗时,能够特异杀伤肿瘤细胞,有效避免靶向杀伤高表达CD44的正常细胞,为以CD44为靶点进行的肿瘤靶向治疗研究提供了新的依据。但本研究对CD44活化状态的研究尚处于初级阶段,所用细胞局限为乳腺肿瘤细胞,其他肿瘤尚未涉及,有待进一步探索。另外,有关正常与肿瘤细胞表面不同活化状态CD44的产生机制及其生物学意义,仍需进一步深入研究。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|