作者简介:戴悦,女,1981年生,学士,技师,主要从事生化、免疫检验工作。
近年来已有许多实验证明半胱氨酸蛋白酶抑制剂C(cystatin C,Cys C)是检测肾功能的新的内源性标志物[ 1, 2]。Cys C在临床诊断以肾病为主的疾病具有非常重要的价值。越来越多的实验室已开展了Cys C的测定。全自动生化分析仪应用的原理是液相透射比浊法,而特定蛋白分析仪应用原理是颗粒增强散射比浊法。由于检测原理和仪器不同,不同方法的结果可能有所差异。为了解液相透射比浊检测系统和颗粒增强散射比浊检测系统测定结果偏差的大小,我们按美国临床实验室标准化委员会(NCCLS)EP9-A2文件[ 3],对以上2种检测系统进行了方法对比和偏差评价。
1. 仪器 罗氏MODULAR P800全自动生化分析仪(简称P800)和西门子BN-Ⅱ特定蛋白分析仪(简称BN-Ⅱ)。
2. 试剂及定标品 液相透射比浊检测系统使用广东虹业抗体科技有限公司提供的Cys C透射比浊检测试剂盒(批号:20120301),配套定标品、质控品。颗粒增强散射比浊检测系统使用由西门子公司提供的Cys C测定试剂盒(产品编号:OQNM13,批号:40706)。定标品:N蛋白定标品UY,批号49854。质控品:伯乐52390。
3. 样本收集 从上海市第八人民医院检验科采集的门诊及住院患者的标本中,按EP9-A2文件中对比要求选取一定浓度范围内的新鲜血清40份。
每天选取8份临床患者当日样本,分别置于样本盘1~8号位置上,用2种检测系统对其进行双份平行测定。测定顺序为1→8,8→1。以上步骤重复5 d。实验结束后质控分别在控当天实验结果才被采用,有一方失控,结果不予采纳,找到失控原因后第2天进行重复测定。比对方法参考NCCLS EP9-A2文件(用患者样本进行方法对比以及偏倚评估)。本研究以BN-Ⅱ(颗粒增强散射比浊系统)作为对比系统(X变量),以广东虹业抗体科技有限公司提供的Cys C试剂盒和P800组成的液相透射比浊系统作为测试系统(Y变量),对两者数据进行比对分析。
统计学分析方法按偏倚评估程序进行。初步数据检查:计算每种方法的各个样本双份测定间差值的绝对值,并以绝对差均值的4倍为可接受限进行数据检查;X变量取值范围的检查:修正系数 r作为评价X变量范围是否足够宽泛的评价指标;线性回归分析按下列方程进行描述: Y=b X+a;计算预期的偏差和可信区间;作图运算采用Microsoft Office Excel程序软件分析。
1. 方法重复测试的离群点检查 为了研究是否有单独的数据点落在范围之外,需要进行方法内重复测试的离群点检查。数据详见 表1。所有数据都要进行离群值检查,计算可接受限。如果有数据点落在范围之外,则必须对该差异的产生进行分析调查,并且将落在范围之外的数据点从数据库内删除,重新计算可接受限。当有2个以上的数据点被删除,需要对此产生的原因进行分析,找到原因后将数据补充完整。如果既没有找出原因,也无法通过调整重复性测定间的最大差异的手段进行调整,则需要停止实验并通知厂商。经过计算,本研究数据均在可接受限范围内。
| 表1 离群点检查 |
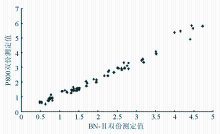
2. 离群点和非连续性变量对2方法比较的影响 为了消除非线性关系,离群点和非连续性变量对2系统比较的影响,需要作图进行检查,观察2系统测定的数据之间是否具有线性关系。由于长期以来,BN-Ⅱ都具有一定的稳定度和准确性保证,因此将BN-Ⅱ测定数据作为横坐标,P800测定数据作为纵坐标。从 图1中可以观察到2种系统数据呈线性关系。此外在散点图的基础上加了一条通过原点,斜率为1.0的直线。由此图中观察到,数据并非均匀分布在直线两边,而是集中偏向一侧。提示数据之间可能存在偏倚,即P800的测定结果高于BN-Ⅱ的结果。
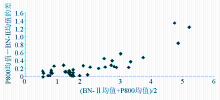
3. 2种检测系统的偏差 以[BN-Ⅱ均值( 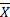


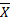
按照NCCLS EP9-A2文件, r≥0.975或 r2≥0.95则认为标本的取值范围足够宽,其测定误差对回归估计的影响可忽略不计,可用直线回归计算斜率和截距。通过直线回归计算得到结果为 Y=1.216 X-0.139, r2=0.978。可以认为测定范围合适,同时2种检测系统间线性关系较好。
根据临床使用要求,选择参考区间(0.53~0.95 mg/L)2个端点和试剂的线性范围达到的水平7.85 mg/L作为3个医学决定水平,结合线性回归方程来评估2种检测系统间的预期偏差和95%可信区间。由于美国临床实验室改进修正法案(CLIA'88)中并没有规定Cys C的可接受误差范围,因此以1/2本实验室规定的允许误差( TEa=20%)为限。Cys C浓度在0.53、0.95 mg/L时的预期偏差能接受,而浓度在7.85 mg/L时的预期偏差不可以接受。见 表2。
| 表2 Cys C的预期偏差和95%的可信区间 |
Cys C是一种半胱氨酸酶抑制物,相对分子质量为13 250,可由所有有核细胞产生。随着其在临床上的广泛应用和研究的深入[ 4],Cys C检测方法也在不断进步[ 5]。要实现同种项目在不同分析系统中的检测结果具有可比性是实验室也是质量管理的最终目的。
不同检测系统影响Cys C测定结果差异因素主要由于方法学差异,测定程序校准差异,不精密度差异,试剂差异,仪器漂移故障等[ 6]。ISO15189(医学实验室——质量和能力的专用要求)和IS0/IEC17205(检测和校准实验室能力的通用要求)明确提出了医学实验室检测结果的溯源性和可比性。强调方法学比对实验是实现准确度溯源和患者样本检验结果可比性的重要途径[ 7]。
本研究依据NCCLS EP9-A2文件对血清Cys C 2种检测系统进行方法学对比和偏差评估。结果显示2种检测系统的测定结果具有较好的相关性,与文献[ 8]结果基本一致。在0.53、0.95 mg/L浓度时,允许误差在95%可信区间范围内,预期偏差能接受。而在7.85 mg/L浓度时,允许误差<95%可信区间下限,提示2种检测系统得出得结果不具一致性,预期偏差不可以接受。EP9-A2文件(2002)与EP9-A文件(1995)[ 9]的不同之处在于EP9-A2文件是计算预期偏差的95%可信区间,并判断 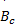
造成2种检测系统测定结果之间差异的主要原因可能是由于标准化溯源性的差异[ 11]。根据厂商提供的资料显示,2种检测系统中Cys C参考物质都是由各自厂商所制备的高纯度蛋白,且没有追溯至国际认证的一级参考物质(ERM-DA471/IFCC)[ 12]。另外,有研究表明即使在测量相同的量时,透射比浊法与散射比浊法2种不同的测量程序也会提供不同的结果[ 13]。因此要实现Cys C测量程序标准化也是十分重要的。
综上所述,虽然2种检测系统之间有所差异,但在测定低浓度样本时,还是能保证两者测定结果的一致性。在高浓度样本时,应注意两者测定结果的偏差。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|